Madelung-Konstante
In der Kristallographie ist die Madelung-Konstante (nach Erwin Madelung, der sie zuerst ableitete)[1] ein einheitenloser Faktor, der definiert ist als:
mit
- , der durchschnittlichen Bindungsenergie pro Ion im Kristallgitter und
- , der durchschnittlichen Bindungsenergie pro Ion bei einem einzelnen Ionenpaar.
Die Madelung-Konstante hängt nur vom Strukturtyp ab, nicht aber von der Ionenladung oder den Gitterparametern.
Typische Kristallstrukturen, auf die die Madelung-Konstante anwendbar ist, sind die Alkalihalogenide, bei denen die Bindung durch Coulombkräfte entsteht. Dabei gibt das Alkaliatom ein Elektron an das Halogenatom ab, und an jedem Atom entsteht eine kugelsymmetrische Ladungsverteilung.
Weil die Madelung-Konstante vom Coulomb-Gesetz für Punktladungen abgeleitet ist, verliert sie ihre Gültigkeit bei nicht-punktförmigen Ionen (Ionen mit kovalenten Bindungen wie z. B. im Pyritkristall) und bei Ionen mit unterschiedlicher Polarität (z. B. in der Reihe ZnS, TiO2, CdCl2, CdI2).
Berechnung der Bindungsenergie im Gitter
Die Bindungsenergie für ein Ionenpaar lässt sich mittels Coulomb-Gesetz wie folgt berechnen:
mit
- z – Ladungszahl der Ionen
- e – Elementarladung
- d – (kleinster) Abstand der Ionen
- ε0 – Dielektrizitätskonstante des Vakuums
Da in einem Kristallgitter nicht nur ein Ionenpaar vorhanden ist, sondern im Raum weitere Kat- und Anionen, wird bei der Kristallbildung weitere Energie frei, allerdings auch wieder benötigt, um gleich geladene Ionen anzunähern. Die folgende Gleichung soll dies erläutern:
Die im Gitter gespeicherte Energie EIG ergibt sich dabei als die Summe der bei der Gitterbildung frei gewordenen und benötigten Energien zu jedem Ion. Dabei ist n die Anzahl, wie oft ein bestimmtes Ion vorkommt, und c ein Faktor, der den Abstand des Ions angibt. Diese Faktoren können zu einem, vom Kristall abhängigen Faktor α – der Madelung-Konstante – zusammengefasst werden, so dass sich für die Bindungsenergie eines Ions im Gitter folgende Gleichung ergibt:
Diese Gleichung beschreibt die Bindungsenergie nur eines Ions im Gitter. Um die Energie zu erhalten, die bei der Bildung einer bestimmten Stoffmenge frei wird, muss diese Gleichung noch mit der Avogadro-Konstanten sowie der Stoffmenge multipliziert werden:
Wie man sehen kann, ist dieser Wert negativ, da die Gitterbildung exotherm ist. Zur genaueren Berechnung von Gitterenergien reicht die alleinige Betrachtung von regelmäßig angeordneten Coulomb-Punktladungen nicht aus. Eine Erweiterung des Modells führt zur Born-Landé-Gleichung.
Berechnung der Madelung-Konstante am Beispiel von NaCl
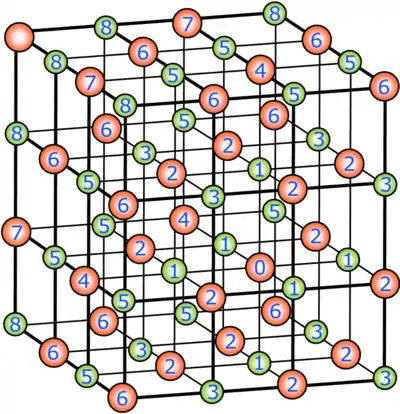
Beim Ionengitter von NaCl handelt es sich um eine kubisch flächenzentrierte Kristallstruktur, wie sie rechts abgebildet ist (rot sind die Anionen und grün die Kationen). Der Abstand der beiden Ionen beträgt bei NaCl etwa d = 0,3 nm.
Aus der oben genannten Gleichung müssen nun die Anzahl der jeweiligen benachbarten Ionen n, deren relativer Abstand c als Vielfaches vom Abstand d sowie deren Ladung, also, ob sie sich anziehen oder abstoßen, bestimmt werden.
Wenn wir von einem Ion, z. B. dem rot dargestellten mit der Nummer 0 ausgehen, haben wir so als erstes n=6 Ionen (grün mit der Nummer 1 dargestellt) im Abstand von 1d, die angezogen werden. Danach folgen 12 rote Ionen (2), deren Abstand mittels Satz des Pythagoras den Wert ergibt und die vom gleichartigen Ion abgestoßen werden, sowie 8 grüne Ionen im Abstand von , die angezogen werden. Die folgende Tabelle setzt diese Zahlen fort:
| Nr. | n | c | Ladung |
|---|---|---|---|
| 1 | 6 | + | |
| 2 | 12 | - | |
| 3 | 8 | + | |
| 4 | 6 | - | |
| 5 | 24 | + | |
| … | … | … | … |
Setzt man diese Prozedur fort, so gelangt man zu folgender, in der Literatur häufig anzutreffender Reihendarstellung der Madelung-Konstante:[2]
Dieses ist jedoch falsch, weil diese Reihe divergiert, wie erst 1951 bewiesen wurde.[3][4] Die Summe über die Punkte des Kristallgitters ist bedingt konvergent, hängt also von der Reihenfolge der Summanden ab. Die obige Reihe würde einer Summation über konzentrische Kugelschalen entsprechen, was auch physikalisch nicht sinnvoll ist. Der „richtige“ Wert ergibt sich, indem über die Gitterpunkte innerhalb eines Würfels mit Kantenlänge summiert und der Grenzwert für gebildet wird. Eine mathematische Begründung, dass dieser Wert der „richtige“ ist, erfolgte 1985 durch David Borwein, Jonathan Borwein und Keith F. Taylor:[4] Sie definieren eine Funktion einer komplexen Variablen :
- ,
wobei der Strich bedeutet, dass der Term wegzulassen ist. Für hinreichend großen Realteil von ist die Reihe absolut konvergent, die Madelung-Konstante () ergibt sich durch analytische Fortsetzung.
Die Summation über Würfel konvergiert so langsam, dass sie für praktische Berechnungen unbrauchbar ist. Mit einem kleinen Trick können jedoch wesentlich bessere Näherungen gefunden werden: Es wird über alle Punkte innerhalb eines Würfels mit Kantenlänge summiert, die Punkte auf den Seiten werden nur halb gezählt, die an den Kanten zu einem Viertel und die an den Ecken zu einem Achtel. Dieses Verfahren ist als Evjen-Methode bekannt.[5] Bereits liefert mit 1,7470 einen sehr guten Näherungswert; = 1,74750 und = 1,7475686. Die physikalische Motivation dieses Verfahrens ergibt sich aus der Forderung, dass die Partialsummen über einen elektrisch neutralen (endlichen) Kristall gebildet werden sollen.
Bereits vor Evjen veröffentlichte Paul Peter Ewald das heute als Ewald-Methode bekannte Verfahren zur Berechnung der Madelung-Konstante.[6] Seine Methode ist ein Spezialfall der Poissonschen Summenformel, was Ewald jedoch nicht bekannt war.
Heute stehen zahlreiche numerische Methoden und leistungsfähige Computer zur Verfügung, sodass die Berechnung der Madelung-Konstanten für beliebige Gitter mit hoher Genauigkeit kein Problem mehr darstellt.
Werte für einige Kristallstrukturen
| Strukturtyp | Madelung-Konstante[7] |
|---|---|
| NaCl Anm. 1 | 1,747564594633… |
| CsCl Anm. 2 | 1,762675… |
| Zinkblende Anm. 3 | 1,633806… |
| Titan(IV)-oxid | 2,40… |
| Calciumfluorid | 2,52… |
| Kupfer(II)-oxid | 4,12… |
| Saphir | 4,17… |
Einzelnachweise
- E. Madelung: Phys. Zs. 19, (1918), S. 524.
- Charles Kittel: Einführung in die Festkörperphysik. Oldenbourg, München und Wien 1999, ISBN 3-486-23843-4.
- O. Emersleben: Math. Nachr. 4 (1951), S. 468.
- D. Borwein, J. M. Borwein, K. F. Taylor: Convergence of Lattice Sums and Madelung’s Constant. In: J. Math. Phys. 26 (1985), S. 2999–3009, doi:10.1063/1.526675.
- H. M. Evjen: On the Stability of Certain Heteropolar Crystals. In: Phys. Rev. 39 (1932), S. 675–687, doi:10.1103/PhysRev.39.675
- P. P. Ewald: Die Berechnung optischer und elektrostatischer Gitterpotentiale. In: Ann. Phys. 64 (1921), S. 253–287, doi:10.1002/andp.19213690304
- Rudolf Gross, Achim Marx: Festkörperphysik. 1. Auflage. Oldenbourg Verlag, München 2012, ISBN 978-3-486-71294-0, S. 119.