Lehmstedt-Tănăsescu-Reaktion
Die Lehmstedt-Tănăsescu-Reaktion auch bekannt als Lehmstedt-Tănăsescu-Methode oder die Lehmstedt-Tănăsescu-Acridon-Synthese ist eine Namensreaktion der organischen Chemie. Die Reaktion wurde nach dem rumänischen Chemiker Ioan Tănăsescu (1892–1959), der sie 1928 entdeckte,[1] und dem deutschen Chemiker Kurt Lehmstedt benannt. Mit Hilfe dieser Reaktion können Acridone und deren Derivate aus 2-Nitrobenzaldehyd und aromatischen Komponenten synthetisiert werden.[1][2][3][4][5]
Übersichtsreaktion
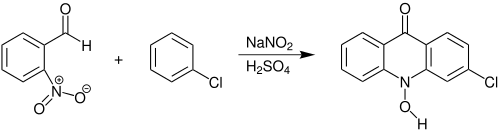
In Gegenwart von Schwefelsäure und katalytischen Mengen Natriumnitrit reagieren 2-Nitrobenzaldehyd und Chlorbenzol zu 3-Chloracridon.[2]
Anstelle von Chlorbenzol können auch andere Benzolderivate mit 2-Nitrobenzaldehyd zu Acridon oder den entsprechenden Derivaten reagieren.
Mechanismus
Da zu dem Mechanismus nur begrenzte Informationen vorliegen, ist die folgende Darstellung nur ein vorgeschlagener Reaktionsverlauf. Unter den sauren Reaktionsbedingungen wird aus Natriumnitrit Salpetrige Säure, welche die Nitrogruppe reduziert und sich selbst zu Salpetersäure oxidiert. Diese oxidiert später die Alkoholgruppe und reduziert sich damit wieder zu Salpetrigen Säure.[2]
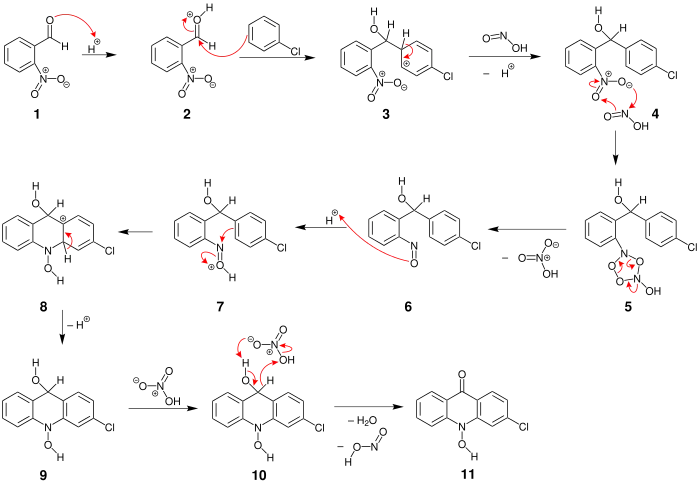 Reaktionsmechanismus der Lehmstedt-Tănăsescu-Reaktion[2]
Reaktionsmechanismus der Lehmstedt-Tănăsescu-Reaktion[2]
Zunächst wird die Carbonylgruppe des 2-Nitrobenzaldehyds 1 protoniert. Es folgt ein nukleophiler Angriff des Chlorbenzols auf das partiell positiv geladene Kohlenstoffatom der Carbonylgruppe 2. Unter Abspaltung eines H+-Ions rearomatisiert dar Sechsring des Chlorbenzols 3. Außerdem positioniert sich ein Molekül Salpetrige Säure in der Nähe der Nitrogruppe 4. Die Salpetrige Säure reduziert die Nitrogruppe über den Zwischenzustand eines fünfgliedrigen Ringes 5 zu einer Nitrosylgruppe 6 und verlässt das Molekül oxidiert als ein Salpetersäure-Molekül. Die Nitrosylgruppe wird protoniert und dann wiederum von dem Aromaten des Chlorbenzols nukleophil angegriffen 7. Durch die Abspaltung eines Protons 8 findet dann erneut eine Rearomatisierung statt 9. Abschließend wird die Alkoholgruppe durch die Salpetersäure zur Ketogruppe oxidiert 10, die Salpetrige Säure liegt erneut als Katalysator vor und als Produkt 11 entsteht ein Acridonderivat.
Einzelnachweise
- J. J. Li: Name Reactions in Heterocyclic Chemistry II. John Wiley & Sons, Inc., Hoboken, New Jersey 2011, ISBN 978-0-470-08508-0, S. 368–369.
- Z. Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents, 3 Volume Set. John Wiley & Sons, Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 1731–1732.
- Ioan Tănăsescu: Bull Soc Chim Fr. Band 41, 1927, S. 528.
- Kurt Lehmstedt: Eine einfache Synthese des Acridons und 3-substituierter Acridone (IX. Mitteil. über Acridin). In: Berichte der deutschen chemischen Gesellschaft (A and B Series). 65, Nr. 5, 1932, S. 834–839, doi:10.1002/cber.19320650531.
- Kurt Lehmstedt, Karl Schrader: Synthesen in der Acridonreihe (XVII. Mitteil. über Acridin). In: Berichte der deutschen chemischen Gesellschaft (A and B Series). 70, Nr. 7, 1937, S. 1526–1538, doi:10.1002/cber.19370700714.