Kranzquallen
Die Kranzquallen (Coronatae) sind eine Ordnung der Schirmquallen (Scyphozoa). Derzeit sind 51[1] rsp. 57[2] Arten beschrieben. Sie kommen bis in sehr große Tiefen vor und werden auch Tiefsee-Quallen genannt.
| Kranzquallen | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
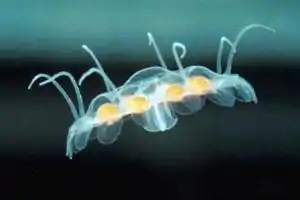
Nausithoe aurea | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Coronatae | ||||||||||||
| Vanhöffen, 1892 |
Geografisches Vorkommen sowie Verbreitung
Die Coronaten sind sowohl im Litoral als auch in der Tiefsee borealer, subtropischer und tropischer Meere nachgewiesen.
Merkmale
Die meisten Arten der Coronatae sind metagenetisch, d. h., sie besitzen ein Polypen- und ein Medusenstadium. Bei einigen Arten ist das Medusenstadium jedoch reduziert oder die Medusen bleiben zeitlebens auf einem ephyraähnlichen Entwicklungsstadium stehen.[3]
Ihre Polypen, die sich durch eine typische Peridermröhre aus Chitin auszeichnen, werden nach Gerhard Jarms (* 1948/49?) als Stephanoscyphistomae bezeichnet.[4] Der rückziehbare Kopfteil des Weichkörpers des Polypen ragt im ausgestreckten Zustand aus dieser Röhre heraus.[3] Der untere Weichkörper ist tetraradialsymmetrisch und weist vier perradiale Gastraltaschen auf, die durch vier interradiale Gastralsepten gebildet werden. Wandständig liegt in jedem Septum ein Muskelstrang. Der Kopfteil trägt die Tentakel und besitzt in seinem Inneren einen Ringkanal, der perradial über vier kurze Radiärkanäle in die Gastraltaschen mündet.[5]
Bei den Arten, die ein Medusenstadium bilden, ist der Zentralteil der Exumbrella vom Randbereich, der aus Randlappen, Tentakeln, Pedalien und statischen Organen besteht, durch eine Ringfurche deutlich abgegrenzt.[6] Die Medusengeneration wird durch einen als Strobilation bezeichneten Prozess gebildet, bei der durch Querteilung des Polypenweichkörpers Scheiben abgeschnürt werden, die sich in Ephyren umwandeln. Die Ephyren wachsen nach der Ablösung vom Polypen im freien Wasser zu geschlechtsreifen Medusen heran.
Die Oberfläche des Schirms wird bei diesen Quallen durch eine Ringfurche eingeschnürt und in eine Oberglocke und einen mit Lappen versehenen Randkranz geteilt. Dieser Randkranz ist für die deutsche Bezeichnung dieser Ordnung namensgebend. Der Schirm kann hoch gewölbt sein, die Form eines Fingerhutes haben, oder ganz flach sein. Der maximale Durchmesser beträgt 38 Zentimeter. Tiefseeformen sind meist violett, dunkelrot oder schwarzbraun gefärbt, je tiefer der Lebensraum liegt, umso dunkler ist ihre Färbung.
Die Polypen der Tiere werden bis zu neun Zentimeter lang und sind von einer aus Chitin bestehenden Peridermhülle umgeben, die nur den Polypenkopf freigibt. Bei der Kronenqualle (Periphylla periphylla) fehlt das Polypenstadium.
Lebensweise
Die Medusen fast aller Arten entlassen ihre Keimzellen in das freie Wasser und sterben anschließend ab. Die Befruchtung und die sich anschließende Entwicklung bis zur Planulalarve findet im freien Wasser statt. Die Larven suchen ein geeignetes Substrat auf und wandeln sich in sessile Polypen um.[7] Innerhalb der Nausithoidae treten neben den normalen metagenetischen Generationswechseln auch oft Entwicklungszyklen auf, die in unterschiedlicher Weise reduziert sind. Bei Nausithoe racemosa und Nausithoe eumedusoides[8] ist die Medusengeneration auf kurzlebige Eumedusoide reduziert. Die Keimzellen werden schon vor der Medusoidbildung in den Septen der Polypen angelegt. N. racemosa entlässt die Keimzellen direkt in das freie Wasser,[9] wohingegen N. eumedusoides Brutpflege betreibt. In den hermaphroditischen Medusoiden entwickeln sich die Keimzellen weiter bis zur Planula.[8] Die Art Nausithoe aurea[10] dagegen ist in der Lage, zwei unterschiedliche Entwicklungswege zu beschreiten. Einerseits können normale, getrenntgeschlechtliche Medusen mit acht Gonaden gebildet werden, andererseits ist eine vegetative Fortpflanzung durch die Umwandlung von Ephyren zu Planuloiden möglich.[10][11] Eine ausschließlich asexuelle Fortpflanzungsweise findet sich bei der Art Nausithoe planulophora.[12] Die durch Strobilation gebildeten Ephyrenanlagen wandeln sich direkt in Planuloide um.[12] T. zibrowii besitzt einen besonders abgewandelten Entwicklungszyklus, bei dem keine Medusen auftreten; es treten ausschließlich weibliche Individuen auf, die sich parthenogenetisch fortpflanzen.[3][13] Die Eizellen entwickeln sich in einer als Eisack bezeichneten Struktur bis zur Planula, die sich dann nach einer kurzen planktischen Phase wieder in einen Polypen umwandelt. Im Gegensatz zur geschlechtlichen (amphimiktischen) tritt eine parthenogenetische Fortpflanzungsweise im Tierreich im Allgemeinen eher selten auf, ist aber innerhalb vieler verschiedener Stämme beschrieben. Ein parthenogenetischer Reproduktionsmodus ist z. B. bei den Rädertierchen (Rotatoria), Bauchhärlingen (Gastrotricha), Weichtieren (Mollusca), Ringelwürmern (Annelida), Spritzwürmern (Sipunculida), Gliederfüßern (Arthropoda), Bärtierchen (Tardigrada) und Stachelhäutern (Echinodermata) nachgewiesen.[14] Bei den Nesseltieren treten eine ganze Reihe parthenogenetischer Arten auf. Werner hat eine parthenogenetische Fortpflanzungsweise bei der Anthomeduse Margelopsis haeckeli beschrieben.[15] Innerhalb der Anthozoa tritt eine parthenogenetische Reproduktionsweise bspw. bei Alcyonium hiberniculum, Tubastraea und Pocillopora auf. Die Seeanemonen Cereus pendunculatus und Sagartia troglodytes können sowohl auf zweigeschlechtlichem als auch auf parthenogenetischem Wege Nachkommen produzieren.[14] Parthenogenese ist eine eingeschlechtliche Fortpflanzung, bei der sich die Eizelle ohne Befruchtung entwickelt. Es gibt eine ganze Reihe unterschiedlicher Formen der Parthenogenese, im Labor kann sie auch künstlich, durch chemische oder physikalische Stimuli, ausgelöst werden. Grundsätzlich unterscheidet man die so genannte apomiktische Parthenogenese, bei der keinerlei Rekombination stattfindet, von der automiktischen, bei der eine Reduktionsteilung auftritt und der vollständige Chromosomensatz durch bestimmte Aufregulierungsmechanismen anschließend wiederhergestellt wird.[16] Man trennt weiterhin die Amphitokie, bei der beide Geschlechter aus den unbefruchteten Eizellen entstehen können (bspw.: Anneliden) von der Arrhenotokie, bei der immer nur Männchen entstehen (z. B.: Bienen, Milben) und der Thelytokie, bei der immer nur Weibchen entstehen (bspw.: Daphnien, Rotatorien). Weiterhin gibt es die Unterscheidung zwischen der obligatorischen Parthenogenese, bei der die Eizellen über viele Generationen stets unbefruchtet bleiben (bspw.: Rotatorien, Ostracoden) und der zyklischen Parthenogenese (Heterogonie), bei der nach mehreren Generationen mit parthenogenetischer Fortpflanzung wieder eine Generation mit zweigeschlechtlicher Fortpflanzung auftritt (bspw.: Blattläuse). Besonders unter Arthropoden kommt eine geografische Parthenogenese vor, bei der sich innerhalb einer Art eine amphimiktische und eine parthenogenetische Rasse ausbildet (Fioroni, 1987). Nach derzeitiger Kenntnis ist T. zibrowii eine Art, bei der ausschließlich weibliche Tiere auftreten, die sich parthenogenetisch fortpflanzen.[3][13] Über die genaueren Abläufe dieser Parthenogenese war bislang nichts bekannt. Bisherige Beobachtungen während der langen Kulturzeit führen zu der Hypothese, dass es sich um eine obligatorische und automiktische Parthenogenese handelt. Außerdem lässt sich vor dem Hintergrund der unterschiedlich reduzierten Entwicklungszyklen innerhalb der Familie Nausithoidae die Hypothese aufstellen, dass T. zibrowii die Form ist, bei der die regressive Evolution der Medusengeneration am weitesten fortgeschritten ist. Von diesen Hypothesen ausgehend wird in dieser Arbeit sowohl der Frage nachgegangen, ob sich bei der biologischen Untersuchung der Eisackbildung Belege für eine ehemals vorhandene Medusengeneration finden lassen, als auch der Frage, ob sich Nachweise für das Auftreten einer Meiose bei der Eizellenbildung finden lassen.
Systematik
- Ordnung Kranzquallen (Coronatae Vanhöffen, 1892)
- Familie Atollidae Bigelow, 1913
- Gattung Atolla Haeckel, 1880
- Familie Atorellidae Vanhöffen, 1902
- Gattung Atorella Vanhöffen, 1902
- Gattung Stephanoscyphus Allman, 1874
- Familie Linuchidae Haeckel, 1879
- Gattung Linantha Haeckel, 1880
- Gattung Linuche Eschscholtz, 1829
- Familie Nausithoidae Bigelow, 1913
- Gattung Nausithoe Koelliker, 1853
- Gattung Palephyra Haeckel, 1880
- Gattung Thecoscyphus Werner, 1984
- Familie Paraphyllinidae Maas, 1903
- Gattung Paraphyllina Maas, 1903
- Familie Periphyllidae Haeckel, 1880
- Gattung Periphylla Haeckel, 1880
- Gattung Nauphantopsis Fewkes, 1885
- Gattung Pericopla Haeckel, 1880
- Gattung Periphyllopsis Vanhöffen, 1900
- Familie Atollidae Bigelow, 1913
Quellen
Literatur
- H.-E. Gruner, H.-J. Hannemann, G. Hartwich, R. Kilias: Urania Tierreich, Wirbellose 1 (Protozoa bis Echiurida). Urania-Verlag, Berlin 1993. ISBN 3-332-00501-4
- Ilka Sötje: Untersuchungen zur reduzierten Metagenese von Thecoscyphus zibrowii Werner, 1984 (Cnidaria, Scyphozoa), Inauguraldissertation, Universität Hamburg, 2003
Weblinks
- Integrated Taxonomic Information System: Coronatae
Einzelnachweise
- Marymegan Daly, Mercer R. Brugler, Paulyn Cartwright, Allen G. Collin, Michael N. Dawson, Daphne G. Fautin, Scott C. France, Catherine S. McFadden, Dennis M. Opresko, Estefania Rodriguez, Sandra L. Romano & Joel L. Stake: The phylum Cnidaria: A review of phylogenetic patterns and diversity 300 years after Linnaeus. Zootaxa, 1668: 127–182, Wellington 2007 ISSN 1175-5326 Abstract - PDF
- World Register of Marine Species
- B. Werner; H.-E. Gruner (Ed.): Cnidaria. S. 305. In: Lehrbuch der speziellen Zoologie. Band 1: Wirbellose Tiere – 2. Teil: Cnidaria, Ctenophora, Mesozoa, Plathelmithes, Nemertini, Entoprocta, Nemathelminthes, Priapulida. Fischer, Jena 1984
- G. Jarms, U. Båmstedt, H. Tiemann, M. B. Martinussen, J. H. Fosså: The holopelagic life cycle of the deep-sea medusa Periphylla periphylla (Scyphozoa, Coronatae). Sarsia, 1999. 84, S. 55–65
- B. Werner: Contribution to the evolution in the genus Stephanoscyphus (Scyphozoa, Coronatae) and ecology and regeneration qualities of Stephanoscyphus racemosus Komai. Publs. Seto Mar. Biol. Lab., 1970. 18, S. 1–20
- B. Werner: Stephanoscyphus (Scyphozoa, Coronatae) und seine direkte Abstammung von den fossilen Conulata. Helgoländer wissenschaftliche Meeresuntersuchungen, 1966. 13, S. 317–451
- B. Werner: Stephanoscyphus (Scyphozoa, Coronatae) und seine direkte Abstammung von den fossilen Conulata. Helgoländer wiss. Meeresunters., 1966. 13, S. 317–451
- B. Werner: Stephanoscyphus eumedusoides n. spec. (Scyphozoa, Coronatae), ein Höhlenpolyp mit einem neuen Entwicklungsmodus. Helgoländer wiss. Meeresunters. 1974. 26, S. 434–463
- B. Werner: New investigations on systematics and evolution of the class Scyphozoa and the phylum Cnidaria. Publs. Seto Mar. Biol. Lab. 20, S. 35–61
- F. Lang da Silveira, A. C. Morandini: Nausithoe aurea n. sp. (Scyphozoa: Coronatae: Nausithoidae), a species with two pathways of reproduction after strobilation: sexual and asexual. Contributions to Zoology, 1997. 66, S. 235–246
- F. Lang da Silveira, A. C. Morandini: Asexual reproduction in Linuche unguiculata (Swartz, 1788) (Scyphozoa: Coronatae) by planuloid formation through strobilation and segmentation. Proc. Biol. Soc. Washington, 1998. 111, S. 781–794
- B. Werner, C. E. Cutress, J. P. Studebaker: Life cycle of Tripedalia cystophora Conant (Cubomedusae). Nature, 1971. 232, S. 582–583
- I. Sötje, G. Jarms: Detailed description of Thecoscyphus zibrowii Werner, 1984 (Scyphozoa, Coronatae) with remarks on the life cycle. Mitt. hamb. zool. Mus. Inst., 1999. 96, S. 5–13
- C. M. Lively, S. G. Johnson: Brooding and the evolution of parthenogenesis: stratigy models and evidence from aquatic invertebrates. Proc. R. Soc. Lond. (Ser. B), 1994. 256, S. 89–95
- B. Werner: Über die Fortpflanzung der Anthomeduse Margelopsis haeckeli Hartlaub durch Subitan- und Dauereier und die Abhängigkeit ihrer Bildung von äußeren Faktoren. Verh. dt. zool. Ges., Zool. Anz., Suppl., 1955. 18, S. 124–133
- R. N. Hughes: A functional biology of clonal animals. Chapman and Hall, London 1989