Kaliumtetraiodomercurat(II)
Kaliumtetraiodomercurat(II) ist eine chemische Verbindung aus der Gruppe der Kaliumverbindungen, Iodkomplexe und Quecksilberverbindungen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
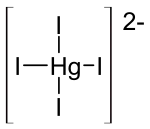 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Kaliumtetraiodomercurat(II) | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | K2[HgI4] | |||||||||||||||
| Kurzbeschreibung |
hellgelber Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 786,48 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
4,29 g·cm−3[2] | |||||||||||||||
| Löslichkeit |
löslich in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
0,02 mg·m−3[2] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Kaliumtetraiodomercurat(II) kann durch Reaktion von Quecksilber(II)-chlorid[3] oder Quecksilber(II)-iodid mit Kaliumiodid gewonnen werden.[4]
Verwendung
Kaliumtetraiodomercurat (auch als Neßlers Reagenz A bezeichnet, nach Julius Neßler, welcher 1856 die Lösung in seiner Dissertation beschrieb)[5] wird in Form einer Lösung zur Stickstoffbestimmung verwendet.[6] In dieser Neßler-Reaktion bildet Kaliumtetraiodomercurat mit Ammoniak einen rotbraunen Farbkomplex [Hg2N]I, das Iodid des Kations der Millonschen Base.[7] Der Nachweis ist sehr empfindlich für Ammonium/Ammoniak und wird in der Wasseranalytik zu dessen quantitativer Bestimmung benutzt. Nachteilig ist die Querempfindlichkeit auf einfache Amine, die in stark belebten Wässern (z. B. Fischteiche, Abwasser) reichlich auftreten.
Die wässrige Lösung von Kaliumtetraiodomercurat (aus 1 Teil Quecksilber(II)-iodid und 1,24 Teilen Kaliumiodid mit einer maximalen Dichte von 3,196 g/cm³) wird auch als Thoulets Lösung bezeichnet. Die nach dem französischen Mineralogen Julien Olivier Thoulet (1843–1936) benannte Lösung kann als Schwerflüssigkeit zur Bestimmung der Dichte von Mineralen und zur Trennung von Mineralgemischen dienen.[8]
Einzelnachweise
- Huey Rong C. Jaw, Margaret M. Mooney, Thomas Novinson, William C. Kaska, Jeffrey I. Zink: Optical properties of the thermochromic compounds disilver tetraiodomercurate(2−) and dicopper tetraiodomercurate(2–). In: Inorganic Chemistry. Band 26, Nr. 9, 1987, S. 1387–1391, doi:10.1021/ic00256a011.
- Eintrag zu Kaliumtetraiodomercurat(II) in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Eintrag zu Mayers Reagenz. In: Römpp Online. Georg Thieme Verlag, abgerufen am 24. August 2017.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1506.
- Julius Neßler: Über das Verhalten des Jodquecksilbers und der Quecksilberverbindungen überhaupt zu Ammoniak und über eine neue Reaction auf Ammoniak. Poppen, Freiburg im Breisgau 1856, urn:nbn:de:bvb:12-bsb10853243-4 (Dissertation, Universität Freiburg).
- Datenblatt Kaliumtetraiodomercurat(II) (PDF) bei Merck, abgerufen am 2. März 2010.
- Eintrag zu Neßlers Reagenz. In: Römpp Online. Georg Thieme Verlag, abgerufen am 24. August 2017.
- Eintrag zu Thoulets Lösung. In: Römpp Online. Georg Thieme Verlag, abgerufen am 23. Juli 2015.


