Millonsche Base
Die Millonsche Base ist eine hellgelbe Stickstoff-Quecksilber-Verbindung der Zusammensetzung (Hg2N)OH · 2 H2O. Sie ist nach ihrem Entdecker Eugène Millon benannt.[3]
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
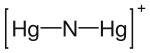 | |||||||
| Allgemeines | |||||||
| Name | Millonsche Base | ||||||
| Summenformel | (Hg2N)OH·2 H2O | ||||||
| Kurzbeschreibung |
hellgelbe kubische Kristalle[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 468,25 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Löslichkeit |
löslich in Wasser[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Gewinnung und Darstellung
Dargestellt wird die Millonsche Base bzw. deren Chlorid durch Kochen des „unschmelzbaren Präzipitats“:
Auch aus Quecksilber(II)-oxid und wässrigem Ammoniak ist die Base zugänglich.[1]
Das Bromid lässt sich durch Reaktion von Quecksilber(II)-bromid mit Ammoniak gewinnen.[4]
Eigenschaften
Die Millonsche Base bildet kubische Kristalle. Die Kationen [Hg2N]+ bilden ein Raumgerüst ähnlich der Cristobalitstruktur (Modifikation von Siliciumdioxid, SiO2)[5], dessen Hohlräume durch Hydroxid-Ionen und Wassermoleküle besetzt werden.[1] Hierbei ist jedes Quecksilberatom linear mit je zwei Stickstoffatomen verbunden, jedes Stickstoffatom ist tetraedrisch von 4 Quecksilberatomen umgeben. Die Millonsche Base sowie ihre Salze stellen somit den Zeolithen ähnliche Ionenaustauscher dar.[6]
Viele andere Salze der Millonschen Base sind bekannt, beispielsweise das Bromid, das orangebraune Iodid, das gelblichweiße, wasserunlösliche Nitrat und das Perchlorat.
Durch die intensive rotbraune Färbung des Iodids der Millonschen Base kann Ammoniak mit Hilfe von Neßlers Reagenz auch noch in Spuren nachgewiesen werden.[7]
Die Base selbst wie auch ihre Salze sind wenig beständig und können insbesondere im trockenen Zustand auf Stoß oder Schlag explodieren.[8] Durch vorsichtiges Erhitzen lässt sich die Base reversibel in die braunen Hydrate (Hg2N)OH · H2O und (Hg2N)OH · 1/2 H2O überführen.[1] Durch vollständige Entfernung des Hydratwassers entsteht das „Anhydrid der Millonschen Base“, (Hg2N)OH.[3]
Einzelnachweise
- Wissenschaft-Online-Lexika: Eintrag zu „Millonsche Base“ im Lexikon der Chemie. Abgerufen am 4. August 2010.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Eintrag zu Millonsche Base. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Januar 2012.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1059.
- W. N. Lipscomb: The structure of Millon’s base and its salts. In: Acta Crystallographica. Band 4, Nr. 2, März 1951, S. 156–158, doi:10.1107/S0365110X51000453.
- Cotton-Wilkinson, Anorganische Chemie, 3. Auflage, Verlag Chemie 1974 ISBN 3-527-25503-6
- S. Ebel, H. J. Roth (Herausgeber): Lexikon der Pharmazie. Georg Thieme Verlag, 1987, ISBN 3-13-672201-9, S. 440.
- Arnold Frederik Holleman, Egon Wiberg, Nils Wiberg: Lehrbuch der Anorganischen Chemie. 81.–90., sorgf. rev., verb. und stark erw. Auflage. de Gruyter, Berlin 1976, ISBN 3-11-005962-2.