Kaliumsulfit
Kaliumsulfit ist eine chemische Verbindung, die als Reduktionsmittel in der chemischen Industrie, vor allem in der Photoindustrie eingesetzt wird.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
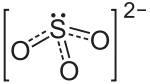 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kaliumsulfit | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | K2SO3 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 158,26 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt |
Zersetzung[2] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen
Kaliumsulfit entsteht bei der Verbrennung von Schwarzpulver.
Gewinnung und Darstellung
Sulfite allgemein entstehen bei der Reaktion von Schwefeldioxid mit Wasser in folgenden zwei Schritten:
Um Kaliumsulfit auf diesem Wege zu erzeugen wird eine Kaliumkarbonat-Lösung mit Schwefeldioxid versetzt und später weiteres Kaliumcarbonat zugegeben.
Bei Umsetzung von Schwefliger Säure mit Kaliumhydroxid:[4]
Chemische Eigenschaften
Kaliumsulfit ist ein Kaliumsalz der Schwefligen Säure. Es zersetzt sich an Luft zu Kaliumsulfat.[5]
Verwendung
Kaliumsulfit wird als Bestandteil von Photochemikalien (Entwicklerlösungen) verwendet.[6][7] Es wird auch als Lebensmittelzusatzstoff (z. B. in Wein) und als Bräunungsbeschleuniger eingesetzt.[5][8][9]
Siehe auch
Einzelnachweise
- Eintrag zu POTASSIUM SULFITE in der CosIng-Datenbank der EU-Kommission, abgerufen am 4. März 2020.
- Eintrag zu Kaliumsulfit in der GESTIS-Stoffdatenbank des IFA, abgerufen am 24. August 2017. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics: A ready-reference book of chemical and physical data. 90. Auflage. Taylor & Francis, Boca Raton, Florida 2009, ISBN 978-1-4200-9084-0, S. 4–83.
- Peter Kurzweil, Paul Scheipers: Chemie. Springer-Verlag, 2012, ISBN 978-3-8348-8280-6, S. 148 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2011, ISBN 978-1-4398-1462-8, S. 333 (eingeschränkte Vorschau in der Google-Buchsuche).
- D. N. Rogers: The Chemistry of Photography From Classical to Digital Technologies. Royal Society of Chemistry, 2007, ISBN 978-0-85404-273-9, S. 54 (eingeschränkte Vorschau in der Google-Buchsuche).
- Hans I. Bjelkhagen: Silver-halide recording materials for holography and their processing MATERIALS... Springer Science & Business Media, 1995, ISBN 978-3-540-58619-7, S. 124 (eingeschränkte Vorschau in der Google-Buchsuche).
- Gerhard Eisenbrand, Peter Schreier, Alfred Hagen Meyer: RÖMPP Lexikon Lebensmittelchemie, 2. Auflage, 2006. Georg Thieme Verlag, 2014, ISBN 3-13-179282-5, S. 1326 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dr. Werner Baltes: Lebensmittelchemie. Springer-Verlag, 2013, ISBN 978-3-662-08281-2, S. 192 (eingeschränkte Vorschau in der Google-Buchsuche).