Isotherme Titrationskalorimetrie
Isotherme Titrationskalorimetrie (ITC, engl. 'isothermal titration calorimetry') ist eine biophysikalische Technik, die zur Bestimmung von thermodynamischen Parametern biochemischer Bindungsprozesse eingesetzt wird. Meist wird dabei die Bindung kleiner Moleküle, etwa medizinisch wirksamer Substanzen, an größere Makromoleküle (Proteine, DNA usw.) untersucht und thermodynamisch charakterisiert. Dies lässt Rückschlüsse auf die Energetik der Bindung sowie die Zahl und das Verhältnis der beteiligten Teilchen zu.
Thermodynamische Messungen
Die ITC ist eine quantitative Messmethode, mit der sich direkt die Bindungsaffinität Ka (Bindungsstärke), Bindungsenthalpie ΔH (Bindungswärme) sowie die Bindungsstöchiometrie n (Verhältnis der beteiligten Teilchen) der untersuchten Interaktion messen lässt. Diese Messungen lassen die Berechnung der Änderung der Gibbs'schen Enthalpie ΔG und der Entropie ΔS durch folgenden Zusammenhang zu:
(wobei R die Gaskonstante und T die absolute Temperatur ist).
Messvorrichtung
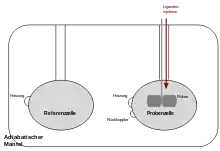
Ein isothermes Titrationskalorimeter besteht aus zwei identischen, hoch wärmeleitenden Materialien (Gold oder Hastelloy), die in adiabatisch ummantelten Zellen eingebaut sind. Empfindliche Thermoelemente erfassen die Temperaturen der Flüssigkeiten innerhalb der Zellen mit hoher Genauigkeit. Eine der beiden Zellen wird als Referenzzelle (mit Wasser oder Pufferlösung) verwendet, die andere dient als Probenzelle, in welcher das Makromolekül in der exakt gleichen Lösung (Wasser oder Puffer) vorliegt. Das Flüssigkeitsvolumen je Zelle beträgt meist wenige ml. Beide Zellen werden zu Beginn mit konstanter Leistung (meist unter 1 mW) beheizt, wobei ein Rückkopplungsmechanismus den Heizmechanismus der Probenzelle abhängig von der Temperatur in der Zelle reguliert.
Durchführung
Während des Experiments werden genau bekannte Mengen des Liganden zugegeben, was entweder zu einer Aufnahme oder einer Abgabe von Wärme an die Flüssigkeit innerhalb der Probenzelle führt. Gemessen wird die zeitabhängige Zufuhr von Energie durch den Heizmechanismus der Probenzelle, welche benötigt wird, um die gleiche Temperatur wie in der Referenzzelle aufrechtzuerhalten.
Bei exothermen Reaktionen (also wenn bei der Bindung des Liganden durch die Makromoleküle in der Lösung Wärme frei wird) steigt die Temperatur der Lösung in der Probenzelle, so dass weniger Energie zugeführt werden muss, um die Probenzelle exakt gleich wie die Referenzzelle zu beheizen. Umgekehrt muss bei einer endothermen Reaktion, welche die Lösung der Probenzelle abkühlt, mehr Energie zugeführt werden. Die Anpassung der zugeführten Energiemenge erfolgt in beiden Fällen durch den oben genannten Rückkopplungsmechanismus.
Auswertung
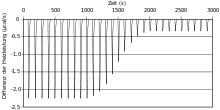
Die Messergebnisse werden als die zur Aufrechterhaltung gleicher Temperaturen benötigte Leistung in μcal/s in Abhängigkeit von der Zeit in s aufgetragen. Auch µJ (statt µcal) als Energieeinheit ist gebräuchlich. Das so erhaltene Diagramm der Rohdaten enthält eine Reihe von „Zacken“, sogenannten Spikes, wobei jeder Spike einer Ligandeninjektion mit folgender Temperaturänderung und Wiedereinstellung der Temperatur durch den Rückkoppler darstellt. Die Fläche unter jedem Spike entspricht der Wärmemenge, die bei dieser Injektion frei wird bzw. aufgenommen wird und kann daher durch Integration in Abhängigkeit von der Zeit bestimmt werden. Das Muster dieser Bindungswärme-Effekte kann als Funktion des molaren Verhältnisses Ligand/Makromolekül analysiert werden, wodurch die thermodynamischen Parameter der untersuchten Interaktion bestimmt werden können. Die Proben sollten vor Beginn des Experiments unter Vakuum entgast werden, da Luftblasen innerhalb der Zellen die Messungen stören und zu abnormen Spektren führen können.
Literatur
- Friedrich Lottspeich, Joachim W. Engels (Hrsg.): Bioanalytik. 2. Auflage. Spektrum Akademischer Verlag, 2006, ISBN 3-8274-1520-9.
- R. O’Brien, J. E. Ladbury, B. Z. Chowdry: Isothermal titration calorimetry of biomolecules. In: S. E. Harding, B. Z. Chowdry (Hrsg.): Protein-Ligand interactions: hydrodynamics and calorimetry. Oxford University Press, 2000, ISBN 0-19-963746-6.
- VP-ITC MicroCalorimeter User’s Manual. 2001 (PDF; 5,8 MB (Memento vom 22. Juni 2015 im Internet Archive)).
- T. Desphande: Isothermal Titration Calorimetry (ITC): Application in Drug Discovery.