Isentropenexponent
Der Isentropenexponent (auch Adiabatenexponent oder Wärmekapazitätsverhältnis genannt) bezeichnet mit dem Symbol (Kappa) oder (Gamma), ist das dimensionslose Verhältnis der Wärmekapazität von Gasen bei konstantem Druck (Cp) zur Wärmekapazität bei konstantem Volumen (CV):
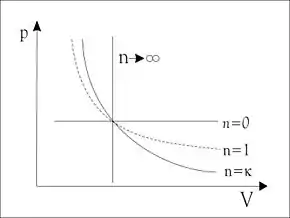
n = 0: isobar,
n = 1: isotherm,
n = κ: isentrop,
n = ∞: isochor
Der Quotient ist eine stark temperaturabhängige Materialeigenschaft realer Gase. Er kann auch aus allen spezifischen - z. B. der massebezogenen oder molaren - Wärmekapazitäten bei konstantem Druck zu konstantem Volumen berechnet werden. Seinen Namen erhielt als Exponent in der Isentropengleichung oder Adiabatengleichung für ideale Gase:
Isentrope Zustandsänderungen sind adiabat. Oft sind sie auch reversibel und lassen damit die Entropie konstant. Sie treten z. B. näherungsweise bei großräumigen Luftströmungen auf, weshalb man diese Kennzahl in der Meteorologie auch als Adiabatenexponent, Adiabatenkoeffizient oder Adiabatenindex bezeichnet. In der Technik ist in der Regel eine adiabate Zustandsänderung (z. B. in einer Dampfturbine) nicht reversibel, da Reibungs-, Drossel- und Stoßvorgänge Entropie produzieren (vergl. „Adiabate Maschine“ und „Zweiter Hauptsatz der Thermodynamik“). Diese Zustandsänderungen lassen sich näherungsweise durch eine Polytrope mit einem Polytropenexponenten n beschreiben, der sich von κ unterscheidet. Die Isentrope ist der Spezialfall einer Polytrope mit (vergl. Bild).
Der Isentropenexponent bestimmt auch die Schallgeschwindigkeit, da die mit dem Schall verbundenen raschen Druck- und Dichteschwankungen näherungsweise isentrop verlaufen. Messen lässt sich der Isentropenexponent mit Hilfe des Rüchardt-Experiments.
| Temp | Gas | κ | Temp | Gas | κ | Temp | Gas | κ | ||
|---|---|---|---|---|---|---|---|---|---|---|
| −200 °C | H2[2] | 1,65 | 0 °C | Luft trocken | 1,40 | −180 °C | N2 | 1,43 | ||
| −73 °C | 1,44 | 400 °C | 1,37 | 20 °C | 1,40 | |||||
| 20 °C | 1,41 | 1000 °C | 1,32 | 500 °C | 1,36 | |||||
| 1000 °C | 1,36 | 2000 °C | 1,30 | 1000 °C | 1,32 | |||||
| 2000 °C | 1,31 | −55 °C | CO2 | 1,35 | 2000 °C | 1,30 | ||||
| −250 bis 1500 °C | He | 1,67 | 20 °C | 1,29 | 20 °C | CH4 | 1,31 | |||
| 400 °C | 1,24 | 350 °C | 1,18 | |||||||
| 100 °C | H2O | 1,33 | 1000 °C | 1,18 | 20 °C | H2S | 1,33 | |||
| 200 °C | 1,32 | 2000 °C | 1,16 | 500 °C | 1,25 | |||||
| 500 °C | 1,28 | 20 °C | CO | 1,40 | 20 °C | NH3 | 1,32 | |||
| 1000 °C | 1,23 | 1000 °C | 1,32 | 450 °C | 1,20 | |||||
| 2000 °C | 1,19 | 2000 °C | 1,29 | −100 bis 500 °C | Ne, Ar Xe, Kr | 1,67 | ||||
| 20 °C | NO[3] | 1,39 | −180 °C | O2 | 1,44 | |||||
| 2000 °C | 1,29 | 20 °C | 1,40 | 20 °C | SO2 | 1,28 | ||||
| 20 °C | N2O[4] | 1,28 | 400 °C | 1,34 | 250 °C | 1,22 | ||||
| 250 °C | 1,22 | 1000 °C | 1,31 | 15 °C | C2H6 | 1,20 | ||||
| 20 °C | NO2[4] | 1,29 | 2000 °C | 1,28 | 15 °C | C3H8 | 1,13 |
| Temp | Gas | κ | Temp | Gas | κ | Temp | Gas | κ | ||
|---|---|---|---|---|---|---|---|---|---|---|
| 126,2 K | N2 | 2,07 | 154,6 K | O2 | 2,25 | 304,1 K | CO2 | 2,36 | ||
| 300 K | 1,67 | 300 K | 1,77 | 500 K | 1,50 | |||||
| 600 K | 1,43 | 600 K | 1,41 | 700 K | 1,28 | |||||
| 2000 K | 1,30 | 1000 K | 1,33 | 1100 K | 1,20 | |||||
| 638,9 K | H2O* | 10,7 | 5,2 K | He | 1,13 | 126,2 K | Ar | 2,07 | ||
| 700 K | 1,95 | 300 K | 1,65 | 300 K | 2,23 | |||||
| 900 K | 1,41 | 700 K | 1,66 | 500 K | 1,81 | |||||
| 1200 K | 1,28 | 1500 K | 1,66 | 700 K | 1,72 | |||||
| 33,15 K | H2 | 1,51 | 132,9 K | CO | 2,54 | 190,6 K | CH4 | 2,00 | ||
| 300 K | 1,42 | 300 K | 1,69 | 300 K | 1,91 | |||||
| 600 K | 1,39 | 400 K | 1,53 | 400 K | 1,47 | |||||
| 1000 K | 1,38 | 500 K | 1,47 | 600 K | 1,24 | |||||
* H2O ist bei 200 bar noch gasförmig und wird erst oberhalb 220,64 bar überkritisch | ||||||||||
Gerechnetes Wärmekapazitätsverhältnis
Der Wert des Isentropenexponenten hängt vom Freiheitsgrad der Gasteilchen ab und der Freiheitsgrad eines Gasmoleküls hängt von der Geometrie und der Bindungsstärke der Atome ab. Gasmoleküle mit mehr Atomen besitzen einen höheren Freiheitsgrad. Der Freiheitsgrad setzt sich zusammen aus Translations-, Rotations- und Schwingungs- bzw. Vibrationsfreiheitsgrad. Translation ist bei allen Temperaturen angeregt. Rotation erfolgt schon bei unteren, Vibration linearer Moleküle erfolgt ab mittleren, Vibration starrer Moleküle erst bei höheren Temperaturen. Deshalb nimmt die Wärmekapazität von mehratomigen Gasen bei steigender Temperatur zu. Anders gesagt: mit abnehmender Temperatur „frieren“ immer mehr Freiheitsgrade ein und der Isentropenexponent nimmt zu.
Bei allen Gasen verläuft die isobare Wärmekapazität über einen großen Temperaturbereich parallel mit der isochoren Wärmekapazität. Deshalb bleibt über einen großen Temperaturbereich auch die Gaskonstante (R = Cp(mol) - CV(mol) = 8,314 J/mol K), also die Differenz zwischen isobarer und isochorer Molwärme gleich.
Der Freiheitsgrad kann näherungsweise wie folgt beschrieben werden:
Der Isentropenexponent kann näherungsweise wie folgt beschrieben werden:
Der Freiheitsgrad f eines Körpers gibt an, wie viele Bewegungsmöglichkeiten dieser Körper innerhalb eines Koordinatensystems hat. Der einzelne Massepunkt hat 3 Freiheitsgrade, er kann sich entlang der x-, y- und z-Achse im Raum bewegen. Er hat keine Rotationsfreiheit, denn ein Punkt kann sich nicht drehen. Ein System von N Punkten hat 3N Freiheitsgrade. Liegen zwischen den Punkten r starre Bindungen vor, so reduziert sich die Anzahl der Freiheitsgrade auf 3N – r.[5] Starre Körper haben gewinkelte Bindungen.
Trockene Luft besteht hauptsächlich aus zweiatomigen Molekülen und hat einen Isentropenexponent von 1,4. Dies entspricht dem theoretischen Wert für 3 Translations- und 2 Rotationsfreiheitsgraden in der kinetischen Gastheorie, da bei zweiatomigen Molekülen eine Rotation um die Verbindungsachse nicht möglich ist. Wasserstoff (H2) hat bei ganz tiefen Temperaturen den gleichen Wert wie die einatomigen Edelgase, weil dann selbst die Rotation gestoppt ist. Die Rotation mehratomiger Moleküle und die Schwingungen linearer oder schwach gewinkelter Moleküle sind schon unterhalb Normaltemperatur angeregt, die Schwingungen starrer Moleküle erst oberhalb Normaltemperatur. Bei viel höheren Temperaturen kommt es durch Dissoziation und Ionisation zu noch mehr Freiheitsgraden. In der Atmosphäre kann es bei Expansion und Abkühlung der feuchten Luft zur Kondensation des Wassers kommen. Durch die freiwerdende Kondensationswärme wird der Exponent niedriger.
| Gasmolekül | Beispiele | ||
|---|---|---|---|
| 1-atomig | Helium, Argon | ||
| 2-atomig | N2, O2, H2, CO, NO | ||
| 3-atomig, starr (gewinkelt) | H2O-Dampf bei 100 °C, H2S | ||
| 3-atomig, nicht starr (linear) | CO2, SO2, N2O[4], NO2[4] | ||
Literatur
- Alfred Böge: Handbuch Maschinenbau. Vieweg+Teubner, Wiesbaden 2011, ISBN 978-3-8348-1025-0.
Weblinks
- Video: Bestimmung von Cp/Cv nach Rüchardt. Institut für den Wissenschaftlichen Film (IWF) 2004, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.3203/IWF/C-14879.
Quellen
- NIST Standard Reference Database Number 69
- Engineering Toolbox: Hochtemperatur-cp-Werte
- Springer-Verlag: Stoffwerte und Tabellen
- Bindungsgeometrie
- dtv-Atlas zur Physik; Mechanik, Akustik, Thermodynamik, Optik. Band 1, München 1987ff, ISBN 3-423-03226-X, S. 49 und 109.