Hofmann-Martius-Umlagerung
Die Hofmann-Martius-Umlagerung ist in der Chemie die säurekatalysierte Umlagerung von N-alkylierten Anilinderivaten zu den entsprechenden ortho- und para-alkylierten Anilinderivaten. Die Reaktion ist mechanistisch mit der Fries-Umlagerung verwandt. Praktisch wird hierzu in der Hitze mit einer anorganischen Säure, meist Salzsäure, gearbeitet.[1]
Die Umlagerungsreaktion ist nach ihren Entdeckern, den deutschen Chemikern August Wilhelm von Hofmann (1818–1892) und Carl Alexander von Martius (1838–1920) benannt.
Übersichtsreaktion
Die Reaktion soll am Beispiel von N-Methylanilin erläutert werden. Dabei kommt es zur Umlagerung der Methylgruppe. Als Produkte werden das p-substituierte Anilin 1 und das o-substituierte Anilin 2 erhalten. Als Katalysator dient dabei eine anorganische Säure wie zum Beispiel Salzsäure.
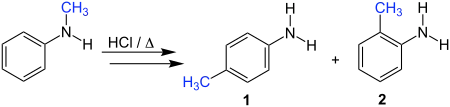
Statt N-Methylanilin können auch andere N-Alkylaniline eingesetzt werden, der Alkylrest ist also variabel.
Reaktionsmechanismus
Der nachfolgende Reaktionsmechanismus wird in der Literatur[2] beschrieben und anhand von N-Methylanilin (3) beispielhaft erläutert.
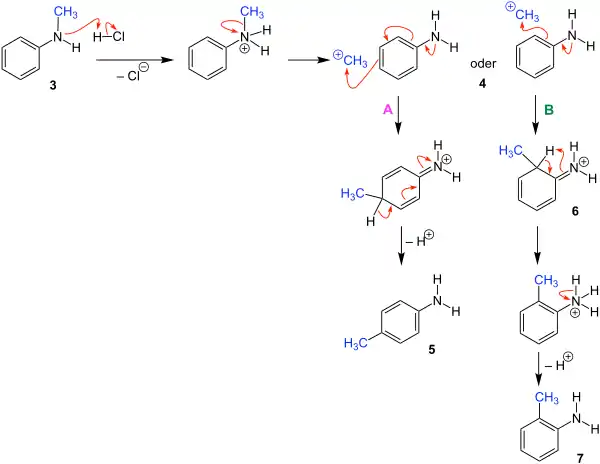
Das Proton der Salzsäure lagert sich zunächst an die Aminofunktion des N-Methylanilins (3) an, es bildet sich ein Hydrochlorid. Dann spaltet sich ein Methylrest kationisch von der Aminogruppe ab und es entsteht als Zwischenstufe die reaktive Zwischenstufe 4. Nun kann es bei 4 zu zwei unterschiedlichen elektrophilen Substitutionen kommen.
Bei Weg A kommt es zu einer Anlagerung der Methylgruppe in para-Stellung. Danach kommt es zu einer Deprotonierung und als Produkt wird das para-substituierte Anilin 5 erhalten.
Bei Weg B kommt es zu einer Anlagerung der Methylgruppe in ortho-Stellung und das Molekül 6 wird gebildet. Durch Elektronenumlagerungen in diesem Molekül kommt es zu einer Wasserstoffanlagerung an dem Stickstoff. Im letzten Schritt kommt es zur Deprotonierung und als Produkt wird das ortho-substituierte Anilin 7 erhalten.
Varianten
Als Variante ist die Reilly-Hickinbottom-Umlagerung bekannt. Sie verläuft mechanistisch gleich, nur werden bei ihr anstelle anorganischer Säuren Metallhalogenide, meist Aluminiumchlorid, als Lewis-Säuren eingesetzt.[3]
Einzelnachweise
- A. W. Hofmann: Methylirung der Phenylgruppe im Anilin. In: Berichte der deutschen chemischen Gesellschaft. Band 4, Nr. 2, Juni 1871, S. 742–748, doi:10.1002/cber.18710040271.
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents, Wiley, 2010, ISBN 9780470638859, S. 1469–1472, doi:10.1002/9780470638859.
- Joseph Reilly, Wilfred John Hickinbottom: Intramolecular rearrangement of the alkylarylamines: formation of 4-amino-n-butylbenzene. In: Journal of the Chemical Society, Transactions. Band 117, Nr. 0, 1920, S. 103–137, doi:10.1039/CT9201700103.