Reilly-Hickinbottom-Umlagerung
Die Reilly-Hickinbottom-Umlagerung ist eine Namensreaktion der organischen Chemie. Sie ist die säurekatalysierte Umlagerung eines N-Alkylanilins in alkylsubstituierte Aniline.[1] Benannt wurde sie nach Joseph Reilly und Wilfred John Hickinbottom (1896–1979), welche von dieser 1920 das erste Mal berichteten.[2]
Die Reaktion ist eine Variante der Hofmann-Martius-Umlagerung, bei welcher anstelle von Metallhalogeniden wie Zinkchlorid, meist anorganische Säuren als Lewis-Säuren eingesetzt werden.[3]
Übersichtsreaktion
Die Reaktion soll am Beispiel von N-Methylanilin erläutert werden. Dabei kommt es zur Umlagerung der Methylgruppe. Als Produkte werden das p-substituierte Anilin 1 und das o-substituierte Anilin 2 erhalten. Als Katalysator dient dabei eine Lewis-Säure wie zum Beispiel Zinkchlorid.
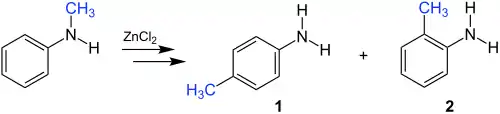
Statt N-Methylanilin können auch andere N-Alkylaniline eingesetzt werden, der Alkylrest ist also variabel. Zudem kann anstelle eines N-Alkylanilins auch ein N,N-Dialkylanilin als Edukt gewählt werden.
Reaktionsmechanismus
Der Mechanismus wird in der Literatur[1] beschrieben und anhand von N-Methylanilin beispielhaft erläutert.
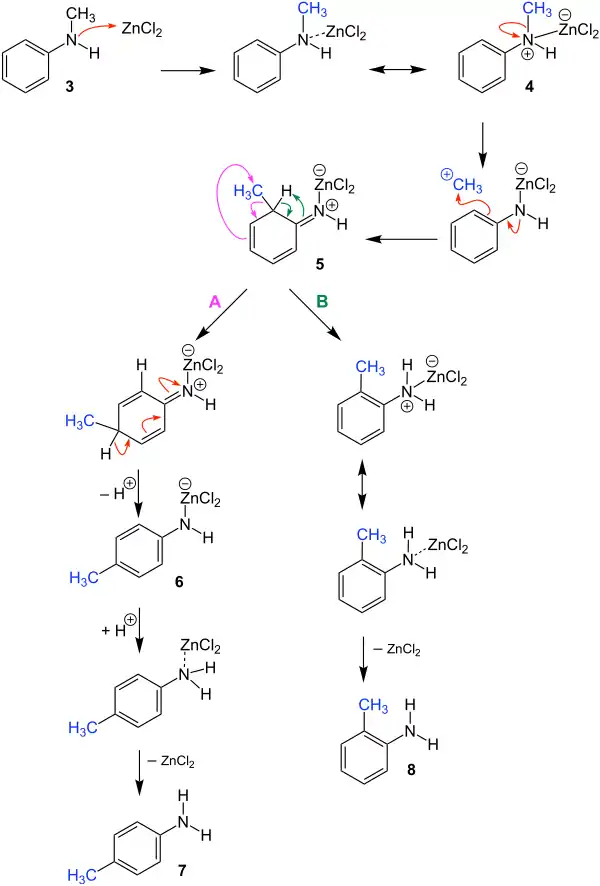
Zunächst lagert sich an das N-Methylanilin 3 das Zinkchlorid an, sodass es zur Bildung der Zwischenstufe 4 kommt. Durch Umlagerung der Bindungselektronen zwischen der Methylgruppe und dem Stickstoff kommt es zur Abspaltung der Methylgruppe. Diese wird im nächsten Schritt in para-Stellung wieder an das Molekül gebunden, sodass das Molekül 5 erhalten wird. In diesem Molekül kann es zu zwei unterschiedlichen Elektronenumlagerungen kommen, welche durch die farblichen Elektronenverschiebungspfeile gekennzeichnet sind.
Bei Weg A kommt es zu einer [1,3]-Umlagerung der Methylgruppe. Es folgt eine Deprotonierung, wodurch das Anion 6 erhalten wird. Durch die Anlagerung des Protons an das Stickstoff kommt es im letzten Schritt zu der Abspaltung des Zinkchlorids. Als Produkt wird das para-substituierte Anilin 7 erhalten.
Bei Weg B kommt es durch die Elektronenumlagerung im Molekül 5 zu einer Wasserstoffanlagerung an dem Stickstoff. Dies führt zu der Abaspaltung des Zinkchlorids und als Produkt wird das ortho-substituierte Anilin 8 erhalten.
Bei der Reaktion ist der Ertrag des para-substituierten Anilins verhältnisweise höher als der des ortho-substituierten Anilins. Deswegen wird vermutet, dass das para-substituierte Anilin zumindest teilweise aus weiteren Umlagerungen der Alkylgruppe bei dem ortho-substituierte Anilin hervorgeht.[1]
Einzelnachweise
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents, Wiley, 2010, ISBN 9780470638859, S. 2326–2328, doi:10.1002/9780470638859.
- J. Reilly und W. J. Hickinbottom: Intramolecular rearrangement of the alkylarylamines: formation of 4-amino-n-butylbenzene In: Journal of the Chemical Society 117, 1920, S. 103, doi:10.1039/CT9201700103.
- A. W. Hofmann: Methylirung der Phenylgruppe im Anilin In: Berichte der deutschen chemischen Gesellschaft 4, 1871, S. 742–748, doi:10.1002/cber.18710040271.