Hexachloroplatinsäure
Hexachloroplatinsäure H2[PtCl6] ist eine chemische Verbindung. Reine Hexachloroplatinsäure ist eine gelbe bis schwach orange, stark hygroskopische, an der Luft zerfließliche Substanz. Bei oft minimal vorhandenen Iridium-Verunreinigungen variiert die Farbe von Rot bis Braun oder ist noch dunkler. Die Salze der Hexachloroplatinsäure bezeichnet man als Hexachloroplatinate. In Isopropanol gelöst wird Hexachloroplatinsäure auch als Speier-Präkatalysator bezeichnet.[5][6]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
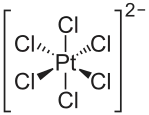 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Hexachloroplatin(IV)-säure | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel |
| |||||||||||||||
| Kurzbeschreibung |
orangefarbener, geruchloser, kristalliner Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 409,81 g·mol−1 (wasserfrei)
517,90 g·mol−1 (Hexahydrat) | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung

Hexachloroplatinsäure kann durch oxidative Auflösung von Platin in Königswasser dargestellt werden:
Aus wässriger Lösung entsteht dabei das Hexachloroplatinsäure-Hexahydrat H2[PtCl6] · 6 H2O, welches sich bis zum Dihydrat entwässern lässt.[8] Darüber hinaus erfolgt ein Zerfall in Wasser, Salzsäure und Platintetrachlorid, da die Protonen der Oxonium-Ionen nach dem Entzug des Wassers keine geeignete Koordinationsstelle am [PtCl6]2−-Ion finden.
Salze
Bei der Umsetzung der Säure mit verschiedenen Kationen wie Kalium (K+), Rubidium (Rb+), Cäsium (Cs+), Ammonium (NH4+), Silber (Ag+) und Thallium (Tl+) entstehen dabei schwerlösliche gelbe Niederschläge der allgemeinen Formel M2[PtCl6], die Hexachloroplatinate.[8]
Verwendung
Hexachloroplatinsäure ist Ausgangsverbindung zur Synthese platinhaltiger Zytostatika, z. B. Cisplatin, Oxaliplatin oder Carboplatin. Hexachloroplatinsäure wird zur Herstellung von Katalysatoren durch Imprägnierung von Trägersubstanzen, zum Beispiel für den Drei-Wege-Katalysator oder für das katalytische Reforming verwendet. Durch Wahl der Imprägnierungsbedingungen kann dabei die Verteilung des Metalls auf dem Träger eingestellt werden.[9]
Siehe auch
Einzelnachweise
- Eintrag zu CHLOROPLATINIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. September 2021.
- Eintrag zu Hexachloroplatinsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Datenblatt Hexachloroplatin(IV)-säure Hexahydrat (PDF) bei Carl Roth, abgerufen am 27. Januar 2022.
- Eintrag zu Hexachloroplatinic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Christoph Elschenbroich: Organometallchemie. 6. Auflage. Teubner Studienbücher Chemie, Wiesbaden 2008, ISBN 978-3-8351-0167-8, S. 617.
- Steinborn: Grundlagen der Metallorganischen Komplexkatalyse. 3. Auflage. Springer Spektrum, ISBN 978-3-662-56603-9, S. 397, doi:10.1007/978-3-662-56604-6.
- Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3.
- Th. Mang, B. .Breitscheidel, P. .Polanek, H. Knözinger: Adsorption of platinum complexes on silica and alumina: Preparation of non-uniform metal distributions within support pellets. In: Applied Catalysis A: General. 106, 1993, S. 239–258, doi:10.1016/0926-860X(93)80180-X.



