Grätzel-Zelle
Die Grätzel-Zelle (auch Farbstoffsolarzelle; englisch dye-sensitized solar cell, kurz DSSC, DYSC oder DSC) dient der Umwandlung von Lichtenergie in elektrische Energie. Es handelt sich um eine Anwendung aus der Bionik, die ihrer Funktion nach auch elektrochemische Farbstoff-Solarzelle genannt wird. Diese Solarzelle ist nach Michael Grätzel (EPFL, Lausanne, Schweiz) benannt, der sie 1991 erfand und 1992 patentieren ließ.[1][2]
Die elektrochemische Farbstoff-Solarzelle verwendet zur Absorption von Licht nicht ein Halbleitermaterial, sondern organische Farbstoffe, zum Beispiel den Blattfarbstoff Chlorophyll. Mit diesem natürlichen Farbstoff wurden als bionische Modellsysteme 1972 an der Universität Berkeley die ersten Farbstoffzellen betrieben[3].
Seit der Erfindung der Grätzel-Zelle in den 90ern gibt es zahlreiche Variationen der traditionellen Grätzel-Zelle mit unterschiedlichem Aufbau und Funktionsprinzip, weswegen der Begriff Farbstoffsolarzelle vor allem im wissenschaftlichen Bereich eine größere Beliebtheit genießt.

Aufbau
Die traditionelle Farbstoffsolarzelle (DSSC) ist eine n-typ Farbstoffsolarzelle, deren Aufbau der Solarzelle, die von Grätzel entwickelt wurde, am nächsten ist. Generell kann man unterscheiden in n-DSSC (traditionell) und p-DSSC, deren Hauptunterschied in dem verwendeten Halbleiter liegt, der in einer traditionellen n-DSSC der n-Halbleiter Titandioxid (TiO2) ist, während eine p-DSSC einen p-Halbleiter verwendet.[4]
Eine DSSC besteht aus zwei planaren (Glas-)Elektroden mit einem Abstand von typischerweise 20–40 µm zueinander. Die beiden Elektroden sind auf der Innenseite mit einer transparenten, elektrisch leitfähigen Schicht (z. B. FTO = englisch Fluorine doped Tin Oxide; dt. Fluor-dotiertes Zinn(IV)-oxid; F:SnO2) beschichtet, die eine Dicke von typischerweise 0,5 µm aufweist.
Die beiden Elektroden werden gemäß ihrer Funktion Arbeitselektrode (Generierung von Elektronen) und Gegenelektrode genannt. In einer n-typ DSSC ist auf der Arbeitselektrode ist eine etwa 10 µm dicke, nanoporöse Schicht Titandioxid (TiO2) aufgebracht. Auf dessen Oberfläche wiederum ist eine Monoschicht eines lichtempfindlichen Farbstoffes adsorbiert.
Auf der Gegenelektrode befindet sich eine wenige µm dicke katalytische Schicht (meist Platin).
Der Bereich zwischen den beiden Elektroden ist mit einem Redoxelektrolyten, z. B. einer Lösung aus Iod (I2) und Kaliumiodid, gefüllt.
Funktion
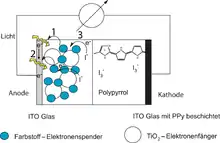
Dieser Vorgang stellt – vereinfacht gesagt – eine technische Photosynthese dar. Die Funktionsweise der Zelle ist allerdings noch immer nicht im Detail geklärt.
Das Redoxsystem (typisch ist hier I−/I3−) ist im Prinzip eine Elektronen „transportierende“ oder „leitende“ Flüssigkeit. Der mit dem Farbstoff benetzte Halbleiter (meist etwa 1 µm Dicke) auf eine TCO-Glasscheibe (z. B. ITO-Glasscheibe) aufgetragen. TCO-Glas ist mit einem elektrisch leitfähigen durchsichtigen Oxid beschichtetes Glas. Als Gegenelektrode wird üblicherweise eine mit Graphit oder Platin beschichtete Platte verwendet.
Im Allgemeinen werden auf Rutheniumkomplexen beruhende Farbstoffe eingesetzt, jedoch sind auch Brombeer- und Hibiskusteeextrakte (Anthocyane) geeignet, welche gut in einer monomolekularen Schicht auf dem TiO2 haften. Titandioxid ist ein n-Halbleiter und für Nanofilme ein geeignetes Material. Es ist aber im sichtbaren Bereich nichtsensibel und absorbiert erst im nahen UV-Bereich, da der Bandabstand zwischen dem Valenz- und Leitungsband 3,2 eV beträgt, was einer Wellenlänge kleiner als 400 nm entspricht, um ein Elektron vom Valenz- in das Leitungsband zu befördern. Farbstoffe wie Anthocyane vermögen über Hydroxygruppen an die TiO2-Oberfläche zu binden und mittels Energietransfer den Halbleiter auch im sichtbaren Bereich des Spektrums zu sensibilisieren.
Anregung:
Das angeregte Farbstoffmolekül (Fs*) überträgt Elektronen in das Leitungsband des TiO2.
Das an der Anode entstehende atomare Iod vereinigt sich zum Molekül (I2), und dieses reagiert mit Iodionen I− zu I3−. Aus diesen Molekülionen werden an der Kathode wieder Iodidionen 3 I− regeneriert.
Einige wissenschaftliche Fragestellungen, die direkt an die in der Grafik markierten Teilprozesse (1) bis (3) anknüpfen, sind in den letzten zehn Jahren geklärt worden. So wurden z. B. die Prozesse (1) und (3) mit zeitaufgelösten Messtechniken direkt gemessen, mit dem Ergebnis, dass der Injektionsprozess (1) weniger als 25 fs dauert, die Rückkehr des Elektrons aus dem TiO2 auf den ionisierten Farbstoff Millisekunden benötigt, bei Zugabe des I3−/I−-Redoxsystems aber der Farbstoff bereits nach ca. 100 ns wieder regeneriert wird.
Wesentliche Leistungssteigerungen wurden durch Beschichtung der Kathode mit einem leitfähigen Polymer wie Polypyrrol erzielt.
Animierte Darstellung zur Funktionsweise
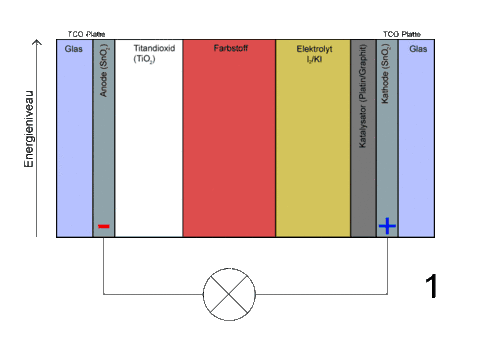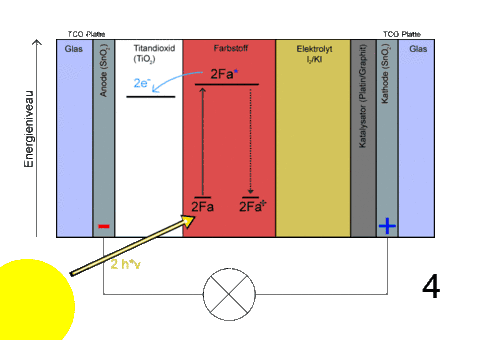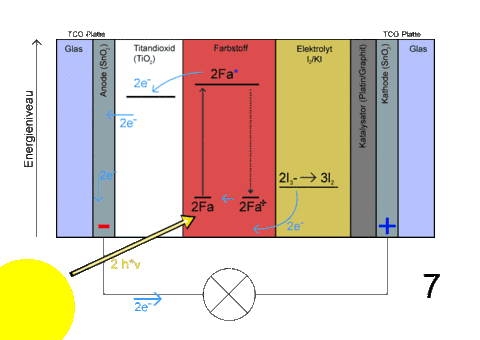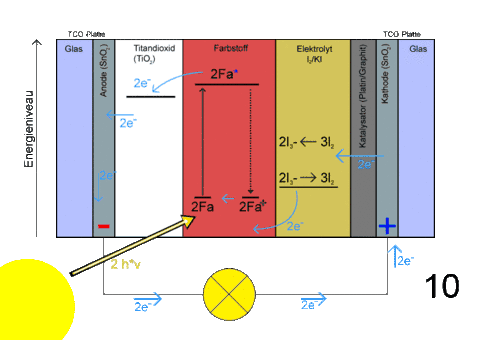
- Beschriftung
- Übersicht Schichtung
- Energieeintrag durch Sonnenlicht
- Durch Absorption von Photonen werden Elektronen in den Farbstoffmolekülen zu höheren Energiezuständen angeregt, also fotooxidiert
- Da dieses Energieniveau oberhalb des Leitungsbandes des Titandioxids liegt, können die Elektronen übertreten – der Farbstoff wird oxidiert
- Das Triiodid des Elektrolyten wird zu Iod oxidiert
- Die dabei freiwerdenden Elektronen werden vom Farbstoff aufgenommen, der so in den Grundzustand übergeht (Reduktion)
- Gleichzeitig werden die Elektronen des Titandioxids über die TCO-Schicht in den Stromkreislauf abgegeben
- Dadurch kann ein Verbraucher angetrieben werden
- Über den geschlossenen Stromkreislauf werden die Elektronen dem Elektrolyten zugeführt
- Das Iod wird zu Triiodid reduziert
- Schichtung von links nach rechts
- Nichtleiter (Glas)
- Beschichtet mit leitendem Material (z. B. SnO2 Zinnoxid)
- Halbleiterschicht TiO2
- Farbstoffmoleküle sind chemisch auf der großen nanokristallinen porösen Oberfläche des TiO2 adsorbiert
- Elektrolyt mit einem redoxaktiven Ionenpaar, typischerweise Iodid
- Katalysatorschicht (z. B. Graphit, Platin, Ruß)
- Leitendes Material als Kathode
- Nichtleiter (Glas)
Bedeutung

Die Vorzüge der Grätzel-Zelle können in den prinzipiell niedrigen Herstellungskosten und in der geringen Umweltbelastung bei der Herstellung liegen. Die Zelle kann diffuses Licht im Vergleich zu den herkömmlichen Solarzellen gut nutzen. Im Labor konnten Zellen bis 12,3 % Wirkungsgrad (zertifiziert) auf einer Fläche von 1 cm² hergestellt werden.[5] Kommerziell erhältliche Module haben einen Wirkungsgrad im Bereich von 2 bis 3 %. Eine der Herausforderungen für Grätzel-Zellen liegt in der Stabilität über längere Betriebszeit. Das gilt insbesondere bei hohen Temperaturen ohne Lichteinfall. Bei Untersuchungen aus dem Jahre 2003 ließ die Effizienz nach 1000 Stunden Lagerung bei 80 °C im Dunkeln um ca. 6 % (?) nach. In einer 2011 publizierten Studie wird die Stabilität als hinreichend für 40 Jahre Betriebszeit in Mitteleuropa und für 25 Jahre in Südeuropa erachtet.[6] Laut ihrem Erfinder sind Steigerungen im Wirkungsgrad bis 31 % für Einzelzellen denkbar.[7] Diese Werte konnten bisher (Stand 2021) jedoch nicht ansatzweise realisiert werden. Der Wirkungsgrad von im Labor hergestellten Zellen konnte bis 2020 nicht weiter verbessert werden und liegt nach wie vor bei 12,3 %.[8] Wirtschaftlich ist die Grätzel-Zelle weiterhin bedeutungslos.
Aufskalierung
Eine große Hürde für die Farbstoffsolarzellen-Technologie auf ihrem Weg vom Labormaßstab zu großflächigen Anwendungen ist die langzeitstabile Versiegelung des Elektrolyten. Als Lösungsansätze existieren vor allem heißschmelzende Polymerkleber, Epoxydharzkleber und Glaslote. Insbesondere Glaslote haben das Potenzial, eine chemisch und thermisch langzeitstabile Versiegelung zu gewährleisten.
Kommerzielle Umsetzung
Bei einem Stadtentwicklungsprojekt in Graz kamen 2016 erstmals Grätzel-Zellen in größerem Umfang zum Einsatz. Zur Fassadengestaltung eines 60 m hohen Bürogebäudes bedecken die Energiezellen eine Fläche von 2000 m².[9]
Weblinks
- Freiburger Materialforschungszentrum an der Albert-Ludwigs-Universität Freiburg
- Einführung in die Technologie der Farbstoffsolarzelle. Innovation Farbstoffsolarzelle. (Kurzbeschreibung im Rahmen des Forschungsprojekts ColorSol: Weiterentwicklung und Produktisierung der Farbstoffsolarzelle).
- Erste industrielle Anwendung
- Herstellen einer organischen Solarzelle
- Experimente zur Grätzelzelle
- Erklärvideo von 3Sat auf YouTube, abgerufen am 6. Oktober 2018.
Einzelnachweise
- Brian O'Regan, Michael Grätzel: A low-cost, high-efficiency solar cell based on dye-sensitized colloidal TiO2 films. In: Nature. Bd. 353, Nr. 6346, 1991, S. 737–740, doi:10.1038/353737a0.
- Patent US5084365: Photoelectrochemical Cells and Process for Making Same. Veröffentlicht am 28. Januar 1992, Erfinder: M. Graetzel, P. Liska.
- Tributsch H., “Reaction of Excited Chlorophyll Molecules at Electrodes and in Photosynthesis” in “Photochem. Photobiol.” 16 (1972) 261–269
- Haining Tian, James Gardner, Tomas Edvinsson, Palas B. Pati, Jiayan Cong: CHAPTER 3:Dye-sensitised Solar Cells. In: Solar Energy Capture Materials. 19. August 2019, S. 89–152, doi:10.1039/9781788013512-00089 (rsc.org [abgerufen am 12. Oktober 2020]).
- Aswani Yella, Hsuan-Wei Lee, Hoi Nok Tsao, Chenyi Yi, Aravind Kumar Chandiran, Khaja Nazeeruddin, Eric Wei-Guang Diau, Chen-Yu Yeh, Shaik M Zakeeruddin, Michael Grätzel: Porphyrin-Sensitized Solar Cells with Cobalt (II/III)–Based Redox Electrolyte Exceed 12 Percent Efficiency. In: Science. Bd. 334, Nr. 6056, 2011, S. 629–634, doi:10.1126/science.1209688.
- Ravi Harikisun, Hans Desilvestro: Long-term stability of dye solar cells. In: Solar Energy. Bd. 85, Nr. 6, 2011, S. 1179–1188, doi:10.1016/j.solener.2010.10.016.
- Ben Schwan: 31 % Wirkungsgrad sind mit intensiver Forschung drin. Technology Review, 23. Juni 2010, abgerufen 10. September 2015.
- Nicole Mariotti, Matteo Bonomo et al.: Recent advances in eco-friendly and cost-effective materials towards sustainable dye-sensitized solar cells. In: Green Chemistry. 22, 2020, S. 7168–7218, doi:10.1039/D0GC01148G
- Der Standard: Schillernder Leuchtturm vom 21. März 2016, geladen am 6. Juni 2017