Glykogen-Debranching-Enzym
Glykogen-debranching-Enzym (Gen: AGL) heißt das Enzym, das Verzweigungen im Glykogen abbaut. Der Abbau dieser Verzweigungen ist ein Teilschritt bei der Verwertung des Reservestoffs Glykogen im Rahmen der Glykogenolyse. Das Enzym kommt in Säugetieren und Pilzen vor.
| Glykogen-Debranching-Enzym (4-α-Glucanotransferase) | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 1532 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Monomer | |
| Isoformen | 6 | |
| Bezeichner | ||
| Gen-Name | AGL | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.4.1.25, Glykosyltransferase | |
| Reaktionsart | Übertragung kurzer Polysaccharidketten | |
| Substrat | Glykogen mit langen Seitenketten | |
| Produkte | Glykogen mit kurzen Seitenketten (ein Glucoserest) | |
| EC, Kategorie | 3.2.1.33, Glykosidase | |
| Reaktionsart | Abspaltung eines Glucoserests | |
| Substrat | Glykogen mit 1,6-Glucoserest | |
| Produkte | lineares Dextrin | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 178 | 77559 |
| Ensembl | ENSG00000162688 | ENSMUSG00000033400 |
| UniProt | P35573 | E0CX86 |
| Refseq (mRNA) | NM_000028 | NM_001081326 |
| Refseq (Protein) | NP_000019 | NP_001074795 |
| Genlocus | Chr 1: 99.85 – 99.92 Mb | Chr 3: 116.74 – 116.81 Mb |
| PubMed-Suche | 178 | 77559 |
Das Enzym ist multifunktionell, es besteht selbst aus zwei Enzymen, die zwei Teilschritte der Reaktion katalysieren: die 4-α-Glucanotransferase und die Amylo-α-1,6-Glucosidase. Im Menschen gibt es mindestens sechs Isoformen, die in verschiedenen Gewebetypen vorkommen. Mutationen am AGL-Gen können zur Glykogenspeicherkrankheit Typ III (Cori-Krankheit) führen.[1]
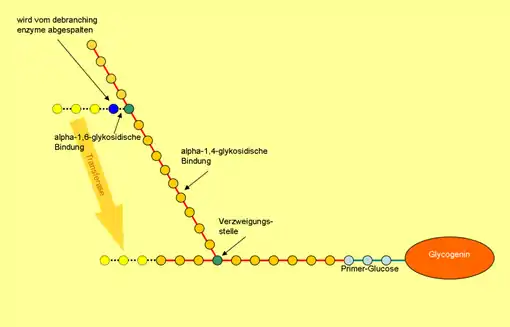
Katalysierte Reaktionen
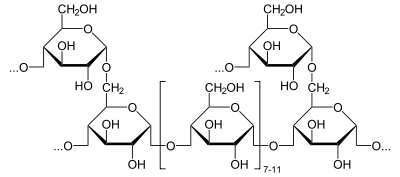

Zunächst wird von der 4-α-Glucanotransferase (EC 2.4.1.25) eine Seitenkette bis auf einen einzelnen Glucoserest auf eine andere Seitenkette übertragen.
 + H2O
+ H2O
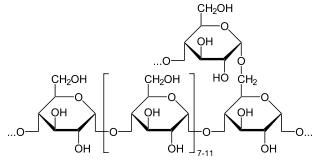 + α-D-Glucose
+ α-D-Glucose
Dann wird der einzelne Glucoserest von der Amylo-α-1,6-Glucosidase (EC 3.2.1.33) hydrolysiert. Der Prozess beginnt von vorn, bis alle Seitenketten abgebaut sind und lineares Dextrin vorliegt.