Glycidamid
Das Glycidamid gehört zu den chemischen Gruppen der Amide und der Oxirane. Glycidamid ist ein als stark krebserzeugend eingestufter Stoff, der in hoch erhitzten Lebensmitteln vorkommt.[4] Er entsteht aus Acrylamid durch Reaktion mit ungesättigten Fettsäuren und Sauerstoff, ist aber wesentlich gefährlicher als dieses, denn schon geringe Mengen können zu Mutationen in Zellen führen. Ein weiterer biologisch relevanter Syntheseweg läuft im Stoffwechsel in der Leber ab, wo Acrylamid zu Glycidamid umgewandelt wird.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
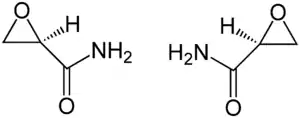 | |||||||||||||||||||
| (R)-Enantiomer (links) und (S)-Enantiomer (rechts) | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Glycidamid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H5NO2 | ||||||||||||||||||
| Kurzbeschreibung |
hellorange Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 87,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,39 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt |
32–34 °C[1] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Synthese
Bei der Umsetzung von Acrylnitril mit Wasserstoffperoxid entsteht racemisches Glycidamid. Die Selektivität und Ausbeute an Glycidamid kann durch kontinuierliche Zugabe von Natronlauge zum Reaktionsgemisch gesteigert werden.[5]
Stereoisomerie
Glycidamid ist chiral. Es gibt zwei Enantiomere dieser Verbindung: (R)-Glycidamid und das dazu spiegelbildliche (S)-Glycidamid. Das Racemat (RS)-Glycidamid ist eine 1:1-Mischung von (R)-Glycidamid und (S)-Glycidamid und ist in der wissenschaftlichen Literatur und diesem Artikel gemeint, wenn Glycidamid ohne Präfix erwähnt wird.
Literatur
- Nicole Puppel: Untersuchungen zur Genotoxizität von Acrylamid und Glycidamid an Säugerzellen. Karlsruhe 2007, DNB 986721964, urn:nbn:de:swb:90-73268 (Dissertation, Universität Karlsruhe).
Einzelnachweise
- Datenblatt Glycidamide bei Sigma-Aldrich, abgerufen am 18. Mai 2017 (PDF).
- Eintrag zu Glycidamid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. Dezember 2014.
- G. B. Payne: Reactions of Hydrogen Peroxide. VI. Alkaline Epoxidation of Acrylonitrile, in: J. Org. Chem. 1961, 26, 651–659. doi:10.1021/jo01062a003
- M. Granvogl, P. Koehler, L. Latzer, P. Schieberle: Development of a Stable Isotope Dilution Assay for the Quantitation of Glycidamide and Its Application to Foods and Model Systems, in: Journal of Agricultural and Food Chemistry 2008, 56, 6087–6092. doi:10.1021/jf800280b
- S. Sugiyama, S. Ohigashi, R. Sawa, H. Hayashi: Selective preparation of 2,3-epoxypropanamide and its facile conversion to 2,3-dihydroxypropanamide with acidic resins, in: Bull. Chem. Soc. Jpn. 1989, 62, 3202–3206. doi:10.1246/bcsj.62.3202.

