Glycerin-3-phosphat-Shuttle
Das Glycerin-3-phosphat-Shuttlesystem ist ein biochemischer Transportmechanismus in Eukaryoten, der dazu dient, die bei der Glycolyse anfallende Reduktionsäquivalente (dort in Form von Nicotinamidadenindinukleotid) für Mitochondrien zur Verfügung zu stellen. Hierbei werden die in NADH gespeicherten Elektronen auf Ubichinon übertragen und somit in die Atmungskette eingespeist, wo sie zur Erzeugung von Adenosintriphosphat (ATP) genutzt werden. NAD+ wird dadurch regeneriert und steht für weitere Stoffwechselprozesse wieder zur Verfügung.
Dieser Shuttle läuft wesentlich schneller als der Malat-Aspartat-Shuttle und wird daher primär in Muskelzellen und im Gehirn verwendet, wo die Energie schnell verfügbar sein muss.
Hintergrund
Im Cytosol eukaryotischer Zellen finden durch katabole Prozesse Oxidationen statt, beispielsweise in der Glykolyse. Dabei werden freiwerdende Elektronen auf NAD+ übertragen, so dass NADH/H+ entsteht. Auch im Zuge des Citratzyklus werden diese Reduktionsäquivalente gebildet, wobei der Citratzyklus in der Matrix des Mitochondriums abläuft. Zur weiteren Energiegewinnung werden die Elektronen dieser Reduktionsäquivalente in die Atmungskette eingespeist und schließlich auf Sauerstoff übertragen (aerobe Atmung).
Die innere Membran der Mitochondrien ist für NADH bzw. NAD+ nicht durchlässig (permeabel), ebenso nicht für ATP, ADP und Protonen. Hiermit ergäben sich zwei Probleme: Zum einen kann das im Cytosol gebildete NADH nicht in die Matrix des Mitochondriums diffundieren, um dort seine Elektronen in die Atmungskette einzuspeisen. Da dadurch NADH zu NAD+ regeneriert wird, könnte auch NAD+ nicht aus der Matrix ins Cytosol gelangen, um dort an katabolen Prozessen weiter zu partizipieren. Im Beispiel der Glykolyse würde diese schnell zum Erliegen kommen, da die Menge an NAD+ im Cytosol begrenzt ist.
Durch zwei Shuttleprozesse wird aber gesichert, dass die im NADH gespeicherten Elektronen in die Mitochondrien transportiert werden und dieses dadurch zu NAD+ regeneriert wird. Nur so ist ein Ausgleich der Reduktionsäquivalente zwischen Cytosol und Mitochondrien möglich. Eines dieser Shuttle ist der Glycerin-3-phosphat-Shuttlesystem und wird im Folgenden dargestellt.
Mechanismus
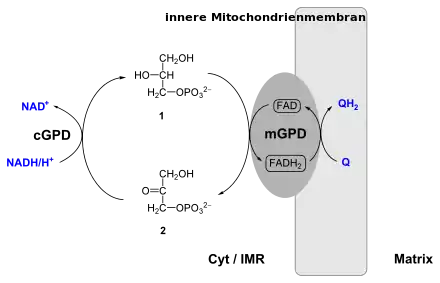
Im Cytosol wird Dihydroxyacetonphosphat (DHAP) zu Glycerin-3-phosphat reduziert. Dabei wird NADH/H+ zu NAD+ oxidiert. Diese Reaktion wird von einer löslichen, NADH/H+-abhängigen cytosolischen Glycerin-3-phosphat-Dehydrogenase (cGPD, EC 1.1.1.8) katalysiert. In einem zweiten Schritt wird an der inneren mitochondrialen Membran das Glycerin-3-phosphat wieder zu Dihydroxyacetonphosphat oxidiert. Die dabei wieder freiwerdenden Elektronen und Protonen werden auf enzymgebundenes Flavin-Adenin-Dinukleotid (FAD) übertragen, das dadurch zu FADH2 reduziert wird. Diese Reaktion katalysiert eine membrangebundene, FAD-abhängige mitochondriale Glycerin-3-phosphat-Dehydrogenase (mGPD, EC 1.1.5.3). Dieses FADH2 wird wieder zu FAD oxidiert, wobei dabei Ubichinon der inneren Mitochondrienmembran reduziert wird. Letzteres gibt die Elektronen an den Komplex III in der Atmungskette weiter.
Der Komplex I der Atmungskette wird bei diesem Shuttle übergangen, so dass in der Bilanz pro FADH2 nur 1,5 Einheiten ATP gebildet werden (bei NADH/H+ sind es 2,5). Bei Benutzung dieses Transportsystems im Gegensatz zum Malat-Aspartat-Shuttle ist die Energieausbeute aus der kompletten Oxidation eines Moleküls Glucose daher etwas geringer, sie beträgt statt durchschnittlich 32 ATP nur 30 ATP.
Einzelnachweise
- Ansell, R. et al. (1997): The two isoenzymes for yeast NAD+-dependent glycerol 3-phosphate dehydrogenase encoded by GPD1 and GPD2 have distinct roles in osmoadaptation and redox regulation. In: EMBO J. 16(9); 2179–2187; doi:10.1093/emboj/16.9.2179, PMID 9171333, PMC 1169820 (freier Volltext).
- Shen, W. et al. (2006): Involvement of a glycerol-3-phosphate dehydrogenase in modulating the NADH/NAD+ ratio provides evidence of a mitochondrial glycerol-3-phosphate shuttle in Arabidopsis. In: Plant Cell 18(2); 422–441; doi:10.1105/tpc.105.039750, PMID 16415206, PMC 1356549 (freier Volltext).