Glycerin-3-phosphat-Dehydrogenase
Glycerin-3-phosphat-Dehydrogenasen (GPD) sind Enzyme, die die Hydrierung von Dihydroxyacetonphosphat (DHAP) zu Glycerin-3-phosphat und die umgekehrte Umsetzung katalysieren. Sie kommen in allen Lebewesen vor.
| Mitochondriale Glycerin-3-phosphat-Dehydrogenase | ||
|---|---|---|
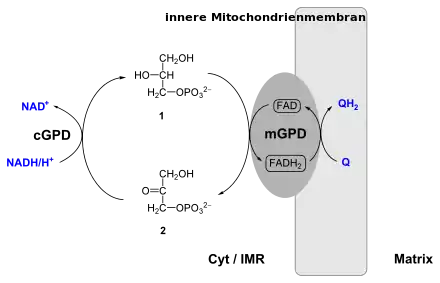 | ||
| Schema des Glycerin-3-phosphat-DHAP-Shuttles. Für Einzelheiten bitte Textinhalt beachten. Abkürzungen: (1) Glycerin-3-phosphat; (2) Dihydroxyacetonphosphat; cGPD cytosolische Glycerin-3-Phosphat-Dehydrogenase; mGPD mitochondriale Glycerin-3-phosphat-Dehydrogenase; Cyt Cytosol; IMR Intermembranraum | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 685 Aminosäuren | |
| Kofaktor | FAD, Ca2+ | |
| Isoformen | 2 | |
| Bezeichner | ||
| Gen-Name | GPD2 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.1.5.3, Oxidoreduktase | |
| Reaktionsart | Dehydrierung | |
| Substrat | FAD + Glycerin-3-phosphat | |
| Produkte | FADH2 + Dihydroxyacetonphosphat | |
| Vorkommen | ||
| Homologie-Familie | GDP | |
| Übergeordnetes Taxon | Lebewesen | |
| Cytosolische Glycerin-3-phosphat-Dehydrogenase [NAD] | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 348 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Kofaktor | NAD | |
| Bezeichner | ||
| Gen-Name | GPD1 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.1.1.8, Oxidoreduktase | |
| Reaktionsart | Hydrierung | |
| Substrat | NADH + Dihydroxyacetonphosphat | |
| Produkte | NAD+ + Glycerin-3-phosphat | |
| Vorkommen | ||
| Homologie-Familie | GPD[NAD+] | |
| Übergeordnetes Taxon | Lebewesen | |
Die genannte Reaktion ist in Eukaryoten notwendig für den Wasserstoff-Transport aus dem Cytosol mittels des Glycerin-3-phosphat-Shuttles in die Mitochondrien: Im Cytosol wird der an NAD gebundene Wasserstoff durch die hydrierende NAD+-abhängige GPD (EC 1.1.1.8) auf Dihydroxyacetonphosphat übertragen und das durch diese Reduktion entstehende Glycerin-3-phosphat diffundiert durch die Mitochondrienmembran in das Mitochondrium. Dort ist die dehydrierende FAD-abhängige GPD in der inneren Mitochondrienmembran lokalisiert (GPD2; EC 1.1.5.3) und überträgt den Wasserstoff vom G3P auf FAD. Das durch diese Oxidation des G3P wieder gebildete Dihydroxyacetonphosphat diffundiert zurück in das Cytosol. In der Mitochondrienmembran wird durch Coenzym Q der Wasserstoff vom FADH2 wieder auf NAD+ übertragen, wobei als Nebenprodukte reaktive Sauerstoffspezies (ROS) entstehen.[1][2]
Zusätzlich zur Funktion in der Atmungskette scheint GPD2 eine Rolle im Spermienstoffwechsel zu spielen, wo sie nicht in Mitochondrien lokalisiert ist. Die Expression von GPD2 wird unter anderem durch T3 über den Thyroidhormonrezeptor stimuliert und ist gewebeabhängig.[3][4][5][6][7]
Weblinks
- Gopinathrao/reactome: Gly-3-P+FAD→DHAP+FADH2 (catalyzed by mitochondrial Gly-Phos dehydrogenase)
- Gopinathrao/reactome: Conversion of Dihydroxyacetone Phosphate to Glycerol-3-phosphate
Einzelnachweise
- Mrácek T, Pecinová A, Vrbacký M, Drahota Z, Houstek J: High efficiency of ROS production by glycerophosphate dehydrogenase in mammalian mitochondria. In: Arch. Biochem. Biophys.. 481, Nr. 1, Januar 2009, S. 30–6. doi:10.1016/j.abb.2008.10.011. PMID 18952046.
- Vrbacký M, Drahota Z, Mrácek T, et al.: Respiratory chain components involved in the glycerophosphate dehydrogenase-dependent ROS production by brown adipose tissue mitochondria. In: Biochim. Biophys. Acta. 1767, Nr. 7, Juli 2007, S. 989–97. doi:10.1016/j.bbabio.2007.05.002. PMID 17560536.
- Kota V, Dhople VM, Shivaji S: Tyrosine phosphoproteome of hamster spermatozoa: role of glycerol-3-phosphate dehydrogenase 2 in sperm capacitation. In: Proteomics. 9, Nr. 7, April 2009, S. 1809–26. doi:10.1002/pmic.200800519. PMID 19333995.
- Wulf A, Wetzel MG, Kebenko M, et al.: The role of thyroid hormone receptor DNA binding in negative thyroid hormone-mediated gene transcription. In: J. Mol. Endocrinol.. 41, Nr. 1, Juli 2008, S. 25–34. doi:10.1677/JME-08-0023. PMID 18562675.
- Mrácek T, Jesina P, Kriváková P, et al.: Time-course of hormonal induction of mitochondrial glycerophosphate dehydrogenase biogenesis in rat liver. In: Biochim. Biophys. Acta. 1726, Nr. 2, November 2005, S. 217–23. doi:10.1016/j.bbagen.2005.06.011. PMID 16039782.
- Weitzel JM, Shiryaeva NB, Middendorff R, et al.: Testis-specific expression of rat mitochondrial glycerol-3-phosphate dehydrogenase in haploid male germ cells. In: Biol. Reprod.. 68, Nr. 2, Februar 2003, S. 699–707. PMID 12533437.
- Weitzel JM, Kutz S, Radtke C, Grott S, Seitz HJ: Hormonal regulation of multiple promoters of the rat mitochondrial glycerol-3-phosphate dehydrogenase gene: identification of a complex hormone-response element in the ubiquitous promoter B. In: Eur. J. Biochem.. 268, Nr. 14, Juli 2001, S. 4095–103. PMID 11454004.