Glaucin
Glaucin ist ein Alkaloid aus der Gruppe der Aporphin-Alkaloide. Es ist im Pflanzenreich weit verbreitet und zum Beispiel unter anderem im Gelben Hornmohn (Glaucium flavum) zu finden. Es wird unter anderem als Mittel gegen Husten verwendet.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Grundstrukturformel (Stereozentrum ist mit einem * markiert) | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Glaucin | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C21H25NO4 | ||||||||||||||||||
| Kurzbeschreibung |
bitter im Geschmack[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 355,43 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[3] | ||||||||||||||||||
| Dichte |
1,14 g·cm3[4] | ||||||||||||||||||
| Schmelzpunkt |
120–125 °C[3] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Bei den Alkaloiden ist es eine gängige Vorgehensweise den Namen von der Pflanzen, in der es das erste Mal entdeckt worden ist abzuleiten, daher leitet sich Glaucin vom „Glaucium“ ab.
Vorkommen

Neben dem Vorkommen im Gelben Hornmohn (Glaucium flavum), findet man Glaucium auch noch in Annonengewächsen (Annonaceae), Berberitzengewächsen (Berberidaceae), Wolfsmilchgewächsen (Euphorbiaceae), Erdrauchgewächsen (Fumarioideae), Lorbeergewächsen (Lauraceae), Magnoliengewächsen (Magnoliaceae), Mohngewächsen (Papaveraceae) und Kreuzdorngewächsen (Rhamnaceae). Viele dieser Pflanzen sind in Europa, Asien und Südamerika verbreitet.
Stereoisomerie
Glaucin ist chiral, es gibt zwei Stereoisomere, jedoch liegt in der Natur i. d. R. nur die (S)-konfigurierte Form vor. Das (R)-konfigurierte Glaucin lässt sich synthetisch aus (S)-Glaucin herstellen. Die beiden Stereoisomere werden wie folgt bezeichnet:
- (S)-5,6,6a,7-Tetrahydro-1,2,9,10-tetramethoxy-6-methyl-4H-dibenzo[de,g]chinolin
- (R)-5,6,6a,7-Tetrahydro-1,2,9,10-tetramethoxy-6-methyl-4H-dibenzo[de,g]chinolin
| Glaucin (2 Stereoisomere) | |
|---|---|
-Glaucin_V2.svg.png.webp) (S)-Konfiguration |
-Glaucin_V2.svg.png.webp) (R)-Konfiguration |
Biosynthese
Im Mohngewächse (Papaveraceae) treten Glaucin 3 und Corydin meist gemeinsam auf, weil die Biosynthese aus dem Norlaudanosolin 1 sich bis zum Norprotosinomenin 2 nicht unterscheidet. Ab dem Norprotosinomenin findet entweder eine Drehung der C-C-Bindung statt oder nicht, dies beeinflusst die Lage der Substituenten am Ring und entscheidet ob Glaucin oder Corydin entsteht. Schematische Darstellung:
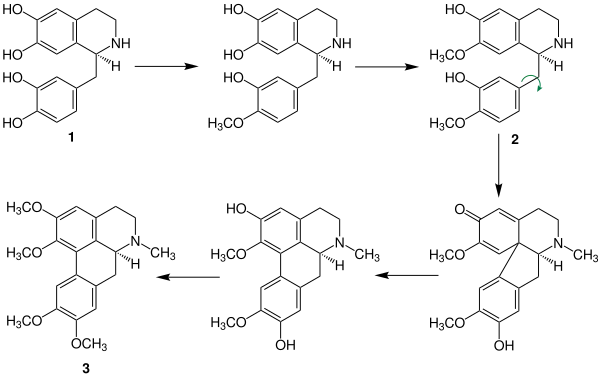
Synthese
Das erste synthetisch hergestellte Aporphin-Alkaloid ist das Glaucin. Die Synthese wurde von Robert Pschorr und Johannes Gadamer mit Papaverin als Ausgangsstoff entwickelt:
Als Erstes wird bei der Synthese das Papaverin 1 mittels Salpetersäure bei niedrigen Temperaturen nitriert und in das Nitropapaverin 2 umgewandelt. Anschließend wird dieses durch Dimethylsulfat am heterozyklischen Ring methyliert und so entsteht 3. Mit Zinn und Salzsäure wird die Nitrogruppe reduziert und es bildet sich das r-Aminolaudanosin 4, welches in saurer Lösung mit Natriumnitrit versetzt zur Diazoverbindung 5 wird. Im letzten Schritt wird die Diazoverbindung mit Kupferpulver versetzt und unter sichtbarer Stickstoffgasentwicklung erfolgt der Ringschluss zu Glaucin 6:[7][8]
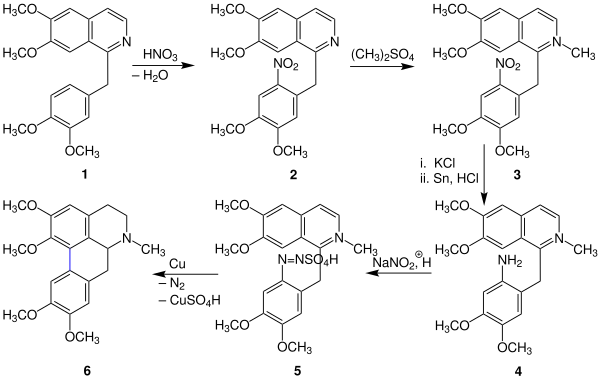
Verwendung
Glaucin hat ein großes pharmakologisches Wirkungssprektrum, zum Beispiel kann es entzündungshemmend wirken, jedoch auch Krämpfe sowie Bewusstlosigkeit oder Atemlähmungen verursachen.
Als Antitussivum (Mittel gegen Husten) wird es in Bulgarien und anderen Ländern eingesetzt und ähnelt in der Wirkung dem Codein, jedoch soll es eine längere Wirkungsdauer besitzen. Es zeichnet sich dadurch aus, dass das zentrale Atemzentrum nicht unterdrückt wird und Glaucin bei längerer Anwendung nicht süchtig macht.[9]
Glaucin wird selten auch als Rauschdroge verwendet, wobei Wirkungen wie Halluzinationen, Müdigkeit, Erbrechen, Schwindel und verminderter Blutdruck auftreten sollen.[9]
Das Derivat des Glaucins Dehydroglaucin wirkt antibakteriell.
Des Weiteren wirkt Glaucin als Fungizid.
Literatur
- J. Falbe, M. Regitz: Römpp Lexikon – Chemie. 10. Auflage. Thieme, Stuttgart 1997, ISBN 3-13-734710-6.
- Geoffrey A. Cordell: Introduction to Alkaloids: A Biogenetic Approach. John Wiley & Sons, New York u. a. 1981, ISBN 0-471-03478-9.
Einzelnachweise
- Eintrag zu GLAUCINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. September 2021.
- K. H. Bauer: Handbuch der Chemie. Mit Rücksicht auf Pharmacie. Band 2. Verlagsbuchhandlung von C. F. Winter, Heidelberg 1843, S. 1200–1202.
- Ian W. Southon, John Buckingham: Dictionary of Alkaloids. 2. Auflage mit CD-ROM. CRC Press, 1989, ISBN 0-412-24910-3, S. 466 (eingeschränkte Vorschau in der Google-Buchsuche).
- Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons. William Andrew, 2014, ISBN 978-0-323-29060-9, S. 341 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Glaucin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Oktober 2017.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- K. H. Bauer: Der Heutige Stand der Synthese von Pflanzenalkaloiden. Springer Fachmedien, Wiesbaden 1913, ISBN 978-3-322-98170-7, S. 126–129.
- J. ApSimon: the total synthesis of natural products. Wiley Online Library, London 1977, S. 80–81, 121–129, doi:10.1002/9780470129647.
- G. M. J. Meyer, M. R. Meyer, D. K. Wissbach, H. H. Maurer: Studies on the metabolism and toxicological detection of glaucine, an isoquinoline alkaloid from Glaucium flavum (Papaveraceae), in rat urine using GC-MS, LC-MSn and LC-high-resolution MSn. In: wiley online library. Band 48, Nr. 1, 2013, S. 24–41, doi:10.1002/jms.3112.