FMN-bindende Fluoreszenzproteine
FMN-bindende Fluoreszenzproteine (englisch FMN-binding fluorescent proteins, FbFP) sind eine Klasse von sauerstoffunabhängigen Fluoreszenzproteinen, die Flavinmononukleotid (FMN) als Chromophor binden.
| FMN-bindende Fluoreszenzproteine | ||
|---|---|---|
| ||
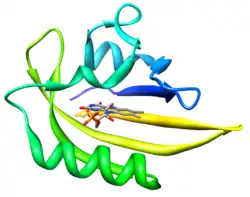
| Typische Kern-domäne eines FbFPs gezeigt am Beispiel von PDB 2PR5 | ||
| Masse/Länge Primärstruktur | ca. 100–150 Aminosäuren / ca. 11–16 kDa | |
| Sekundär- bis Quartärstruktur | Monomer oder Dimer | |
| Kofaktor | FMN | |
Allgemeines
FbFPs wurden aus Blaulichtrezeptoren (den sogenannten light-oxygen-voltage-sensing domains, LOV-Domänen), wie man sie in Pflanzen und Bakterien findet, entwickelt.[1] Sie ergänzen die Fluoreszenzproteine der GFP-Derivate und -Homologe und zeichnen sich insbesondere durch ihre Sauerstoffunabhängigkeit und ihre geringe Größe aus. Sie absorbieren blaues Licht und emittieren Licht im cyan-grünen Spektralbereich.
Entwicklung
LOV-Domänen sind eine Unterklasse der PAS-Domänen und wurden zuerst in Pflanzen als Teil des Phototropins entdeckt, das eine zentrale Rolle beim Wachstum der Pflanze zum Licht hin spielt.[2] Sie binden Flavinmononukleotid (FMN) nicht-kovalent als Cofaktor, der zur Absorption von Blaulicht benötigt wird. LOV-Domänen weisen aufgrund des gebundenen FMNs von sich aus eine Fluoreszenz auf, die jedoch sehr schwach ist. Bei Bestrahlung mit Blaulicht durchlaufen LOV-Domänen zudem einen Photozyklus, bei dem sich eine kovalente Bindung zwischen einem konservierten Cysteinrest und dem FMN ausbildet. Dies führt zu einer Konformationsänderung des Proteins zur Signalweiterleitung und zu einem Verlust der Fluoreszenz. Die kovalente Bindung ist energetisch ungünstig und wird je nach Protein innerhalb von Sekunden bis Stunden wieder gespalten.[3][4][5] Um die Fluoreszenzeigenschaften dieser Proteine besser zu nutzen, wurde der natürliche Photozyklus der Proteine durch genetische Modifikation ausgeschaltet, indem das konservierte Cystein gegen ein Alanin ausgetauscht wurde. Dadurch verbleibt das Protein auch bei Bestrahlung mit Blaulicht im fluoreszierenden Zustand und die Fluoreszenzintensität wird deutlich erhöht.[1]
Durch verschiedene Mutagenesemethoden konnten erste FbFPs weiter verbessert werden. Dabei wurde insbesondere die Helligkeit[6][7][8] aber auch die Photostabilität[2] der Proteine verbessert und deren spektrale Eigenschaften verändert.[8]
Spektrale Eigenschaften
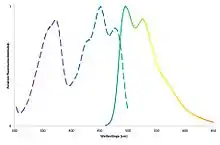
FbFPs haben ein Anregungsmaximum bei einer Wellenlänge von ca. 450 nm (blaues Licht) und einen zweiten ausgeprägten Anregungspeak bei ca. 370 nm (UV-A-Licht). Das Emissionsmaximum liegt bei ca. 495 nm, mit einer Schulter bei ca. 520 nm. Von Pp2FbFP gibt es auch eine Variante (Q116V) deren Anregungs- und Emissionsspektrum jeweils 10 nm hin zu kürzeren Wellenlängen verschoben ist.[8]
Photophysikalische Eigenschaften
Die photophysikalischen Eigenschaften der FbFPs werden durch den Chromophor und seine chemische Umgebung im Protein bestimmt. Der Extinktionskoeffizient (ε) liegt bei allen bislang bekannten FbFPs bei ca. 14.200 M−1cm−1 und ist damit etwas höher als der von freiem FMN (ε = 12.200 M−1cm−1.[9]) Die Fluoreszenz-Quantenausbeute (Φ) variiert stark zwischen den verschiedenen FbFPs und reicht von 0,2 (phiLOV2.1) bis 0,44 (EcFbFP und iLOV).[6][8] Damit wird die Fluoreszenz-Quantenausbeute von freiem FMN (Φ = 0,25[8]) bei Bindung an das Protein teilweise fast verdoppelt. Ein noch deutlicherer Unterschied zeigt sich in der Photostabilität, der Resistenz der Fluoreszenzproteine vor Ausbleichen bei längerer, starker Bestrahlung mit Blaulicht. So dauert es beispielsweise bei dem auf Photostabilität hin optimierten phiLOV2.1 etwa 40-mal so lange bis die Hälfte der Fluoreszenz ausgeblichen ist, wie bei freiem FMN. Dieser Stabilisierungseffekt ist bei fast allen FbFPs zu beobachten, allerdings liegt er meist nur bei etwa 5-mal bis 10-mal.[8] Die durchschnittliche Fluoreszenzlebensdauer der einzelnen FbFPs liegt zwischen 3,17 ns (Pp2FbFP) und 5,7 ns (z. B. EcFbFP).[8] Sie sind damit deutlich länger als die typischen Lebenszeiten von GFP-Derivaten, die typischerweise zwischen 1,5 und 3 ns liegen.[10][11] FbFPs eignen sich daher gut als Donor-Domänen in Förster-Resonanzenergietransfer (FRET) Systemen in Verbindung mit GFP-Derivaten wie z. B. YFP.
Vor- und Nachteile
Der größte Vorteil der FbFPs gegenüber GFP liegt in der Unabhängigkeit von molekularem Sauerstoff. Da bei GFP und allen -Derivaten und -Homologen molekularer Sauerstoff für die Reifung des Chromophors benötigt wird, sind diese Fluoreszenzproteine unter hypoxischen und anaeroben Bedingungen nur eingeschränkt nutzbar.[12] Da FbFPs FMN als Cofaktor binden, bei dessen Synthese kein molekularer Sauerstoff benötigt wird, ist das Fluoreszenzsignal dieser Proteine unter aeroben und anaeroben Bedingungen gleich.[1][13] FbFPs sind typischerweise zwischen 100 und 150 Aminosäuren lang und damit nur etwa halb so groß wie GFP (238 Aminosäuren). Es konnte gezeigt werden, dass diese geringe Größe z. B. bei der Markierung des Tabakmosaikvirus von Vorteil ist.[6] Aufgrund der langen Fluoreszenzlebensdauer von bis zu 5,7 ns eignen sich FbFPs gut als Donor für FRET Systeme in Verbindung mit GFP-Derivaten wie z. B. YFP. Eine Fusion aus EcFbFP und YFP wurde bereits benutzt um den ersten genetisch kodierten Fluoreszenz-Biosensor für Sauerstoff (FluBO) zu entwickeln.[14]
Der größte Nachteil der FbFPs gegenüber GFP ist die geringere Helligkeit (das Produkt aus ε und Φ). So ist das häufig verwendete EGFP mit ε = 55.000 M−1cm−1 und Φ = 0,60[15] etwa fünfmal so hell wie EcFbFP. Ein weiterer Nachteil der FbFPs ist das bisherige Fehlen von Farbvarianten um mehrere Proteine innerhalb einer Zelle oder eines Gewebes zu markieren und im Mikroskop zu unterscheiden. Die bislang größte Spektrale Verschiebung bei FbFP-Varianten beträgt nur 10 nm. Damit ist das Protein zwar mit dem menschlichen Auge von anderen zu unterscheiden,[8] allerdings reicht diese Verschiebung nicht für eine Unterscheidung mittels Fluoreszenzfiltern, wie sie in Mikroskopen verwendet werden.
Einzelnachweise
- Drepper, T., Eggert, T., Circolone, F., Heck, A., Krauss, U., Guterl, J. K., Wendorff, M., Losi, A., Gärtner, W., Jaeger, K. E.: Reporter proteins for in vivo fluorescence without oxygen. In: Nat Biotechnol. 25, 2007, S. 443–445. doi:10.1038/nbt1293. PMID 17351616.
- Christie, J. M., Reymond, P., Powell, G. K., Bernasconi, P., Raibekas, A. A., Liscum, E., Briggs, W. R.: Arabidopsis NPH1: a flavoprotein with the properties of a photoreceptor for phototropism. In: Science. 282, 1998, S. 1698–1701. doi:10.1126/science.282.5394.1698. PMID 9831559.
- Circolone, F., Granzin, J., Jentzsch, K., Drepper, T., Jaeger, K. E., Willbold, D., Krauss, U., Batra-Safferling, R.: Structural Basis for the Slow Dark Recovery of a Full-Length LOV Protein from Pseudomonas putida. In: J Mol Biol. 417, 2012, S. 362–374. doi:10.1016/j.jmb.2012.01.056. PMID 22326872.
- Losi, A. & Gärtner, W.: Old chromophores, new photoactivation paradigms, trendy applications: flavins in LOV and BLUF photoreceptors.. In: Photochem Photobiol. 87, 2011, S. 491–510. doi:10.1111/j.1751-1097.2011.00913.x. PMID 21352235.
- Crosson, S. & Moffat, K.: Structure of a flavin-binding plant photoreceptor domain: insights into light-mediated signal transduction. In: Proc Natl Acad Sci U S A. 98, 2001, S. 2995–3000. doi:10.1073/pnas.051520298. PMID 11248020.
- Chapman, S., Faulkner, C., Kaiserli, E., Garcia-Mata, C., Savenkov, E. I., Roberts, A. G., Oparka, K. J., Christie, J. M.: The photoreversible fluorescent protein iLOV outperforms GFP as a reporter of plant virus infection. In: Proc Natl Acad Sci U S A. 105, 2008, S. 20038–20043. doi:10.1073/pnas.0807551105. PMID 19060199.
- Mukherjee, A., Weyant, K.B., Walker, J. & Schroeder, C.M.: Directed evolution of bright mutants of an oxygen-independent flavin-binding fluorescent protein from Pseudomonas putida. In: Journal of Biological Engineering. 6, 2012, S. 20. doi:10.1186/1754-1611-6-20. PMID 23095243.
- Wingen, M., Potzkei, J., Endres, S., Casini, G., Rupprecht, C., Fahlke, C., Krauss, U., Jaeger, K. E., Drepper, T., Gensch, T.: The photophysics of LOV-based fluorescent proteins - new tools for cell biology. In: Photochem Photobiol Sci. 13, 2014, S. 875–883. doi:10.1039/c3pp50414j. PMID 24500379.
- Whitby, L.G.: A new method for preparing flavin-adenine dinucleotide. In: Biochem J. 54, 1953, S. 437–442. PMID 13058921.
- Goedhart, J., von Stetten, D., Noirclerc-Savoye, M., Lelimousin, M., Joosen, L., Hink, M. A., van Weeren, L., Gadella, T. W., Jr., Royant, A.: Structure-guided evolution of cyan fluorescent proteins towards a quantum yield of 93%. In: Nat Commun. 3, 2012, S. 751. doi:10.1038/ncomms1738. PMID 22434194.
- Jung, G., Brockhinke, A., Gensch, T., Hötzer, B., Schwedler, S., Veettil, S. K.: Fluorescent Proteins I. From Understanding to Design Vol.11. Springer Berlin Heidelberg, 2012, ISBN 978-3-642-23371-5.
- Drepper, T., Gensch, T., Pohl, M.: Advanced in vivo applications of blue light photoreceptors as alternative fluorescent proteins. In: Photochem Photobiol Sci. 12, 2013, S. 1125–1134. doi:10.1039/c3pp50040c. PMID 23660639.
- Walter, J., Hausmann, S., Drepper, T., Puls, M., Eggert, T., Dihné, M: Flavin mononucleotide-based fluorescent proteins function in mammalian cells without oxygen requirement. In: PLoS One. 7, 2012, S. e43921. doi:10.1371/journal.pone.0043921. PMID 22984451.
- Potzkei, J., Kunze, M., Drepper, T., Gensch, T., Jaeger, K. E., Büchs, J.: Real-time determination of intracellular oxygen in bacteria using a genetically encoded FRET-based biosensor. In: BMC Biol. 10, 2012, S. 28. doi:10.1186/1741-7007-10-2. PMID 22439625.
- Patterson, G., Day, R.N. & Piston, D.: Fluorescent protein spectra. In: J Cell Sci. 114, 2001, S. 837–838. PMID 11181166.