Diiodhexaoxid
Diiodhexaoxid ist eine anorganische Verbindung, die als Iodoxid zu den Halogenoxiden gehört.
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
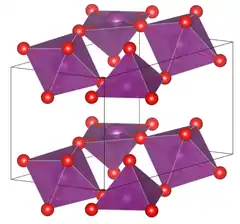 | |||||||
| _ I _ O | |||||||
| Kristallsystem |
triklin | ||||||
| Raumgruppe |
P1 (Nr. 2)[1] | ||||||
| Gitterparameter |
a = 5,006 Å, b = 6.741 Å, c = 6,795 Å, α = 97.1°, β = 96.43°, γ = 105.36°[1] | ||||||
| Allgemeines | |||||||
| Name | Diiodhexaoxid | ||||||
| Verhältnisformel | I2O6 | ||||||
| Kurzbeschreibung |
gelber Feststoff[2] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 349,805 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Dichte |
4,53 g·cm−3 [1] | ||||||
| Schmelzpunkt |
150 °C (Zersetzung)[3] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Darstellung
Die Darstellung von Diiodhexaoxid kann durch vielfältige Wege erfolgen. Möglich ist die Entwässerung von Periodsäure mittels konzentrierter Schwefelsäure:
- .
Alternativ kann die Darstellung durch Reaktion von Periodsäure mit Iodsäure mit Schwefelsäure erfolgen.
Die thermische Zersetzung von meta-Periodsäure im Vakuum führt ebenfalls zur Darstellung von Diiodhexaoxid.[3][5]
Eigenschaften
Unter 100 °C kann Diiodhexaoxid stabil unter Feuchtigkeitsausschluss gelagert werden. Beim Lösen in Wasser findet eine exotherme Reaktion zu Iod- und Periodsäure statt. Bei Erhitzen über 150 °C kann die Zersetzung in Diiodpentoxid beobachtet werden;[3]
- .
Die Verbindung ist diamagnetisch, was auf die unterschiedlichen Oxidationszahlen der Iodatome zurückgeführt wird.[5] Als Festkörper kristallisiert die Verbindung in der Raumgruppe P1 (Raumgruppen-Nr. 2) mit den Gitterkonstanten a = 500,6 pm, b = 674,1 pm, c = 679,5 pm, α = 97.1°, β = 96.43°, γ = 105.36° mit einer Formeleinheit pro Elementarzelle.[1]
Einzelnachweise
- Thorsten Kraft, Martin Jansen: Synthesis and Crystal Structure of Diiodine(V/VII) Hexaoxide: An Intermediate between a Molecular and a Polymer Solid. In: J. Am. Chem. Soc. Band 117, Nr. 25, Juni 1995, S. 6795–6796, doi:10.1021/ja00130a026.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 96. Auflage. (Internet-Version: ), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, S. 4-67.
- A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 543–544 (Leseprobe: Teil A – Grundlagen der Chemie Der Wasserstoff. Google-Buchsuche).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Hans Siebert, Manfred Weise, Ursula Woerner: Über das Jod(V,VII)-oxid J2O6. In: Z. anorg. allg. Chem. Band 432, Nr. 1, Juli 1977, S. 136–140, doi:10.1002/zaac.19774320117.