Difamilast
Difamilast ist ein Arzneistoff aus der Gruppe der Phosphodiesterase-4-Hemmer (PDE-4-Hemmer). Er wurde unter dem Namen Moizerto (Otsuka Pharmaceutical) im September 2021 in Japan zugelassen zur Behandlung der atopischen Dermatitis („Neurodermitis“).[3] Difamilast wird als Salbe auf die Haut aufgetragen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
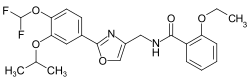 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Difamilast[1] | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C23H24F2N2O5 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| Wirkstoffklasse |
PDE4-Inhibitor | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 446,44 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Wirkungsmechanismus
Phosphodiesterasen sind Enzyme, die im Zellinneren sekundäre Botenstoffe wie etwa das cAMP hydrolytisch abbauen. Difamilast hemmt die Phosphodiesterase vom Typ 4. Die Bildung von entzündungsfördenden Botenstoffen und Zytokinen, die die Symptomatik der atopischen Dermatitis bewirken, wird unterdrückt.
Verwendung
Die Difamilast-Zubereitungen sind zur Behandlung der atopischen Dermatitis bei Erwachsenen und Kindern ab 2 Jahren zugelassen.
Klinische Prüfung
- Difamilast wurde an pädiatrischen Patienten in einer randomisierten, doppelblinden Phase-3-Studie untersucht. Patienten im Alter von 2–14 Jahren mit einem Investigator Global Assessment (IGA)-Score von 2 (milde Krankheitserscheinungen) oder 3 (mittlere Krankheitserscheinungen) erhielten vier Wochen lang zweimal täglich Difamilast-Salbe 0,3 % (n = 83), Difamilast-Salbe 1 % (n = 85) oder nur die wirkstofflose Salbengrundlage (n = 83). Der primäre Endpunkt war der Prozentsatz der Patienten mit einem IGA-Score von 0 (erscheinungsfreie Haut) oder 1 (leichte Krankheitserscheinungen) mit einer Verbesserung um mindestens zwei Grade in Woche 4.
- Die Erfolgsraten im IGA-Score in Woche 4 betrugen 44,6 % und 47,1 % für die beiden Difamilast-Gruppen gegenüber 18,1 % bei der mit Salbengrundlage (Placebo) behandelten Gruppe. Die Erfolgsraten IGA-Score in den Difamilast-Gruppen waren signifikant höher gegenüber der Vergleichsgruppe. Als sekundäre Endpunkte wurden die Verbesserungsraten des Gesamtwerts des Eczema Area and Severity Index um mindesten 50 %, 75 % und 90 % (EASI 50, EASI 75, EASI 90) in Woche 4 gegenüber dem Ausgangswert herangezogen. Sie waren bei den Patienten in den Difamilast-Gruppe signifikant höher als in der nur mit Grundlage behandelten Patienten. Der EASI-Score in den Difamilast-Gruppen war im Vergleich zur Placebo-Gruppe in Woche 1 signifikant reduziert und wurde bis Woche 4 beibehalten. Die meisten behandlungsbedingten unerwünschten Ereignisse waren leicht oder mittelschwer.[4]
- Difamilast wurde an Erwachsenen in einer randomisierten, doppelblinden Phase-3-Studie untersucht, in der die Patienten (15–70 Jahre) mit einem Investigator Global Assessment (IGA)-Score von 2 oder 3 zweimal täglich für 4 Wochen mit Difamilast-Salbe 1 % (n = 182) Salbe oder wirkstoffloser Salbengrundlage (n = 182) behandelt wurden.
- Die Erfolgsrate des IGA-Scores in Woche 4 (primärer Endpunkt), Prozentsatz der Patienten, die einen IGA-Score von 0/1 mit einer Verbesserung um mindestens zwei Grade erreichten, war signifikant höher mit Difamilast 1 % gegenüber wirkstoffloser Salbengrundlage (38,46 % vs. 12,64 %, p < 0,0001). Die Raten für EASI 50, EASI 75, EASI 90 in Woche 4 folgten dem gleichen Trend. Difamilast 1 % bewirkte eine signifikante mittlere Verbesserung des EASI-Gesamtwerts gegenüber der mit Placebo Behandelten von Woche 1 bis Woche 4 gegenüber dem Ausgangswert. Behandlungsbedingte unerwünschte Wirkungen waren meist leicht oder mittelschwer.[5]
Siehe auch
Handelsnamen
Moizerto (J)
Einzelnachweise
- INN Recommended List 80, 9. September 2018.
- invivochem: MSDS Difamilast
- Otsuka's Moizerto® Ointment Granted Approval in Japan as a Treatment for Atopic Dermatitis, Pressemitteilung Otsuka vom 27. September 2021.
- H. Saeki, N. Baba, K. Ito, D. Yokota, H. Tsubouchi: Difamilast, a selective phosphodiesterase 4 inhibitor, ointment in paediatric patients with atopic dermatitis: a phase III randomized double-blind, vehicle-controlled trial. British Journal of Dermatology, 21. Juli 2021. doi:10.1111/bjd.20655. Epub ahead of print
- H. Saeki, K. Ito, D. Yokota, H. Tsubouchi: Difamilast ointment in adult patients with atopic dermatitis: A phase 3 randomized double-blind vehicle-controlled trial. Journal of the American Academy of Dermatology, 25. Oktober 2021. doi:10.1016/j.jaad.2021.10.027. Online ahead of print.