Dichlorhexaoxid
Dichlorhexaoxid ist eine chemische Verbindung aus der Gruppe der Chloroxide.
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Allgemeines | |||||||
| Name | Dichlorhexaoxid | ||||||
| Andere Namen |
Chlorylperchlorat | ||||||
| Summenformel | Cl2O6 | ||||||
| Kurzbeschreibung |
tiefrote Flüssigkeit[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 166,90 g·mol−1 | ||||||
| Aggregatzustand |
flüssig[1] | ||||||
| Dichte |
2,02 g·cm−3[1] | ||||||
| Schmelzpunkt | |||||||
| Siedepunkt |
203 °C (theoretisch)[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Gewinnung und Darstellung
Dichlorhexaoxid kann durch Reaktion von Chlordioxid mit Ozon gewonnen werden.[1][3]
Ebenfalls möglich ist die Darstellung durch Reaktion von Chlorylfluorid und Perchlorsäure.[3]
Eigenschaften
Dichlorhexaoxid ist ein tiefrote Flüssigkeit, die unterhalb von −30 °C unzersetzt aufbewahrt werden kann.[3] Von allen Chloroxiden ist es das am wenigsten explosive, bei Kontakt mit organischen Stoffen explodiert es jedoch. Als Gas dissoziiert es weitgehend zu Chlortrioxid, das bereits bei Zimmertemperatur in Chlordioxid und Sauerstoff bzw. in Chlor und Sauerstoff zerfällt.[1]
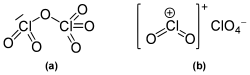
In der Gasphase und als Flüssigkeit liegt es als kovalentes Chlorylperchlorat O2Cl-O-ClO3 vor. Die Oxidationsstufen des Chlors betragen hier V und VII. Im Feststoff existiert die Verbindung als Chlorylchlorat mit isolierten ClO2+ und ClO4− -Ionen.[3][4]
Die Verbindung ist das gemischte Anhydrid aus Chlor- und Perchlorsäure. Bei Reaktion mit Wasser entstehen Chlorsäure und Perchlorsäure[3], mit Ozon langsam Dichlorheptaoxid.
Einzelnachweise
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 315.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Ralf Steudel: Chemie der Nichtmetalle, Synthesen - Strukturen - Bindung -Verwendung, 4. Auflage, 2014 Walter de Gruyter GmbH & Co. KG, Berlin/Boston, ISBN 978-3-11-030439-8, S. 553–554, (abgerufen über De Gruyter Online).
- Klaus M. Tobias, Martin Jansen: Struktur von Cl2O6 im Kristall. In: Angewandte Chemie 98, 1986, S. 994–995, doi:10.1002/ange.19860981108.