Cysteinproteasen
Bei den Cysteinproteasen handelt es sich um eine Gruppe von Enzymen, die zu den Hydrolasen und deren Untergruppe der Proteasen oder Peptidasen gezählt werden.[1]
| Cysteinproteasen | ||
|---|---|---|
| Enzymklassifikation | ||
| EC, Kategorie | 3.4.22.- | |
| Reaktionsart | Proteolyse | |
Zu den Cysteinproteasen (Thiolproteasen) zählen beispielsweise das Enzym Papain, ebenso die Caspasen. Sie sind charakterisiert durch eine sogenannte katalytische Diade, bestehend aus den Aminosäuren Cystein und Histidin. Diese Anordnung bildet das aktive Zentrum des Enzyms aus.
Die Peptidase-Datenbank MEROPS zählt neun Clans von Cysteinproteasen, mit knapp 60 Familien.
Reaktionsmechanismus der Cysteinproteasen
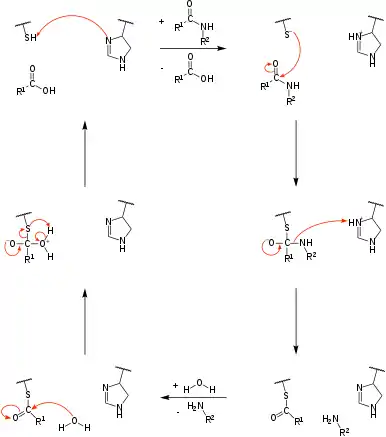
Im Wesentlichen spalten die Proteasen die Peptidbindung.
Dies geschieht folgendermaßen: Das Cystein wird basenkatalytisch durch das Histidin aktiviert, d. h., das Proton der Thiolgruppe wird auf den Stickstoff des Histidins übertragen (oben links im Bild). Das nun positiv geladene Histidin wird durch die negativ geladenen Aspartat-Seitenkette (nicht dargestellt) stabilisiert. Es erfolgt ein nucleophiler Angriff des Thiolats an das C1-Atom der Peptidbindung (oben rechts), sodass ein tetraedrischer Übergangszustand entsteht (mittig rechts). Der Stickstoff der Peptidbindung wird nun säurekatalytisch, d. h., er wird durch das Histidin protoniert abgespalten. Es liegt jetzt eine Thioesterbindung zwischen dem Enzym und dem Rest der Peptidkette vor, ein sogenanntes Acylenzym (unten rechts). Dieses Intermediat wird nun durch Wasser nucleophil am partiell positiv geladenen C1-Atom angegriffen (unten links). Es bildet sich wieder ein tetraedrischer Übergangszustand, bevor das restliche Peptid mit neuer Carboxygruppe abgespalten wird und das verbleibende Proton vom Wasser, die jetzt wieder freie Cysteinseitenkette zum Thiol protoniert (mittig links). Es liegen somit jetzt zwei Teilpeptide mit einem neuen Aminoterminus bzw. einem neuen Carboxylterminus vor.
Beispiele
- Caspasen
- Bromelain
- Papain
- Ficain
- Calpain
- Cathepsine
- Chymopapain