Cryptococcus neoformans
Cryptococcus neoformans ist ein hefeähnlicher, bekapselter Pilz mit weltweiter Verbreitung. Die Art ist 1 bis 5 µm groß, rundlich und weist einen haploiden Chromosomensatz auf. Das geschlechtliche bzw. teleomorphe Stadium von Cryptococcus neoformans heißt Filobasidiella neoformans und wurde 1976 durch Kwon-Chung beschrieben.
| Cryptococcus neoformans | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
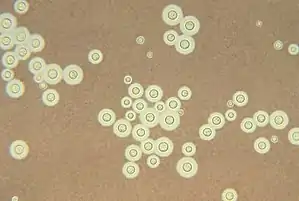
Cryptococcus neoformans | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Cryptococcus neoformans | ||||||||||||
| (San Felice) Vuill. |
Cryptococcus neoformans ist der wichtigste Erreger der Kryptokokkose, einer opportunistischen Infektion, die fast immer bei Patienten mit massiver Immunschwäche auftritt. So gehört die Kryptokokkose zu den wichtigsten AIDS-definierenden Erkrankungen.
Vorkommen
Cryptococcus neoformans kommt weltweit vor. Er wächst in der Erde und auf verschiedenen Gräsern und Getreidearten. Der Pilz ist häufig im Kot verschiedener Vogelarten nachzuweisen. Daraus resultierende Stäube stellen eine Infektionsquelle für den Menschen dar.[1] Unter gesunden Menschen ist der serologische Nachweis von Kontakt mit Cryptococcus neoformans häufig. Dabei erfolgt die Infektion meist im Kindesalter und geht entweder in eine Eliminierung des Erregers oder ein asymptomatisches Latenzstadium über. Als Krankheitserreger beim Menschen kommt Cryptococcus neoformans fast ausschließlich bei Menschen mit reduzierter Leistung des Immunsystems vor. Dies trifft für AIDS-Kranke und Patienten unter immunsuppressiver Therapie zu. Hochrechnungen kommen zu dem Schluss, dass rund 1 Million Menschen jährlich an einer Kryptokokkose erkranken, und rund 600.000 versterben. Die Mehrheit der Fälle steht in Zusammenhang mit der seit Anfang der 1990er Jahre herrschenden HIV-Epidemie.[2]
Krankheitsentstehung
Der Pilz dringt über die Atemwege in den menschlichen Körper ein. Bei immunkompetenten Menschen erfolgt bei Cryptococcus neoformans die Elimination des Erregers oder der Erreger wird vom Immunsystem in einem Granulom abgekapselt. Über Folgen einer latenten Infektion ist beim Menschen nichts bekannt. Im Tiermodell konnte jedoch ein Zusammenhang mit allergischen Atemwegserkrankungen dargestellt werden. Bei Menschen mit Immunschwäche kann der Erreger ins Blut eindringen und überwindet die Blut-Hirn-Schranke.[2] Die Mehrheit der Erkrankungen wird als Reaktivierung einer latenten Infektion gesehen. Rund 20 % werden von mehreren Stämmen befallen und werden als Neuinfektionen aus der Umwelt gewertet.[3] Als mögliche Mechanismen hierzu werden eine direkte Überwindung der Barriere durch Pilzzellen sowie das Einschleppen durch mit Cryptococcus neoformans infizierten Makrophagen diskutiert. Sobald der Erreger in das zentrale Nervensystem eingedrungen ist, induziert er durch seine Vermehrung eine Hirnhautentzündung. Dabei schützt den Erreger seine Polysaccharidkapsel gegen Phagocytose. Ebenso werden große Mengen an Kapselpolysacchariden, welche die Immunantwort stören, in das Gewebe abgegeben. Der Pilz produziert auch Enzyme (unter anderem eine Phospholipase), um das Gewebe des Wirts aufzulösen.[2]
Siehe zur gefährlicheren Form den mutierten Pilz Cryptococcus neoformans var. gattii auch Cryptococcus gattii.
Behandlung
Zur Therapie der Erkrankung stehen die Antimykotika Amphotericin B und Flucytosin sowie die Gruppe der Azole (Fluconazol, Voriconazol, Posaconazol, Itraconazol und andere) zur Verfügung. Diese werden je nach Schwere der Erkrankung in Kombinationen verabreicht. Nach Ausheilung ist meist eine mehrjährige oder lebenslange Erhaltungstherapie notwendig.[4]
Metabolismus
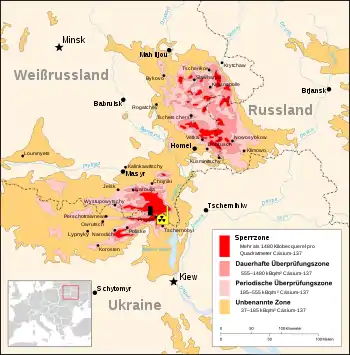
Am 23. Mai 2007 wurde eine wissenschaftliche Arbeit unter der Leitung von Arturo Casadevall veröffentlicht, die von Pilzen, unter anderem von Cryptococcus neoformans, handelt, welche wahrscheinlich mittels Melanin ionisierende Strahlung in für ihren Organismus nutzbare Energie umwandeln.[5] Daraus ergeben sich einige interessante Ansätze:
- Für die direkte Beseitigung von Atommüll sind melaninhaltige Pilze ungeeignet, da sie nur die von den radioaktiven Isotopen produzierte Strahlung teilweise in chemische Energie umwandeln und nicht die Isotope selbst abbauen. Von Interesse sind jedoch die Implikationen, die sich für die Weiterverwertung von Atommüll mittels Pilzen ergeben.
- Es ist denkbar, dass mit Hilfe solcher Pilze während eines Raumfluges Nahrung für Astronauten produziert werden kann. Im Weltall ist überall mehr kosmische Strahlung als von Pflanzen nutzbares Licht vorhanden.
- Weiter stellt sich die Frage, wie groß der Anteil der Biomasse bzw. der Energie ist, die durch Vorgänge erzeugt wird, bei denen Melanin eine zentrale Rolle spielt. Nachdem die von Pilzen erzeugte Biomasse auf unserem Planeten größer ist als die von Pflanzen durch Photosynthese generierte, kann es sein, dass die durch Prozesse mit einer zentralen Rolle von Melanin hergestellte sogar der umfangreichere Teil ist.
Ausdrücklich hervorgehoben wird, dass die Rolle des Melanins bei der Energieerzeugung nach wie vor unklar ist. Klar ist lediglich, dass bei den aus Proben aus dem versiegelten Atomreaktor von Tschernobyl stammenden Pilzen
- eine höhere Stoffwechselrate gegeben war, wenn sie mit Melanin angereichert wurden, als bei unbehandelten Pilzen;
- bei der Energieerzeugung Veränderungen in der Elektronenkonfiguration der Elektronenhülle ihres Melanins nachgewiesen wurde. Dies weist auf ein verändertes Energieniveau hin, das bei der Erzeugung von Energie auch zu erwarten ist.
- Eine auf das Vierfache gestiegene Reduzierung von NAD+ zu beobachten ist, wenn sie radioaktiv bestrahlt werden. Dabei handelt es sich um einen Stoffwechselvorgang.
- Der Metabolismus von Wangiella dermatitidis und Cryptococcus neoformans war bei einer Strahlenbelastung im Ausmaß von rund dem Fünfhundertfachen der natürlichen Strahlenbelastung signifikant aktiver als unter üblichen Bedingungen.
Forschungsgeschichte
Cryptococcus neoformans wurde erstmals 1890 beschrieben.[2]
Einzelnachweise
- Herbert Hof, Rüdiger Dörries: Medizinische Mikrobiologie, 3. Auflage, Stuttgart, 2005, S. 479.
- Arturo Casadevall: Cryptococcosis, in Dan L. Longo, Anthony A. Fauci, Dennis Kasper, Stephen L. Hauser, J. Larry Jameson, Joseph Localzo : Harrison's Principles of Internal Medicine, 18. Auflage, New York, 2012, S. 1648–1651.
- Desnos-Ollivier, M. et al.: Mixed Infections and In Vivo Evolution in the Human Fungal Pathogen Cryptococcus neoformans. In: MBio. 18, Nr. 1, 2010, S. e00091-10. PMID 20689742.
- IDSA Guideline: John R. Perfect et al. : Clinical Practice Guidelines for the Management of Cryptococcal Disease: 2010 Update by the Infectious Diseases Society of America., Clin Infect Dis. (2010) 50 (3): 291-322 doi:10.1086/649858
- Ekaterina Dadachova, Ruth A. Bryan, Xianchun Huang, Tiffany Moadel, Andrew D. Schweitzer, Philip Aisen, Joshua D. Nosanchuk, Arturo Casadevall: Ionizing Radiation Changes the Electronic Properties of Melanin and Enhances the Growth of Melanized Fungi. In: PLoS ONE. 2, 2007, S. e457, doi:10.1371/journal.pone.0000457.
Weblinks
- Cryptococcus neoformans (Memento vom 24. April 2013 im Internet Archive) auf schimmel-schimmelpilze.de
- Cryptococcus neoformans - Datensatz im Index Fungorum