CpG-Dinukleotid
Ein CpG-Dinukleotid ist ein chemischer Zusammenschluss von zwei Nukleotiden, welche die Nukleobasen Cytosin bzw. Guanin aufweisen. Gelegentlich werden andere Bezeichnungen verwendet, wie CG-Stelle, CG-Ort, CpG-Motiv u. ä. Im Englischen sind CpG site und CpG dinucleotide üblich.
Im Allgemeinen bezieht sich der Begriff „CpG-Dinukleotid“ auf eine Stelle innerhalb vom Erbgut (DNA), der die Anteile Desoxycytidin – Phosphorsäure – Desoxyguanosin (in 5'–3'-Richtung) enthält. Aufgrund der komplementären Basenpaarung an einer solchen Stelle, die auch CpG-Stelle genannt wird, kommen im DNA-Doppelstrang an jeder Stelle zwei Dinukleotide vor.
Die CpG-Stellen spielen in den Genomen mancher Lebewesen (z. B. bei Säugetieren) eine besondere Rolle, weil sie dort Gegenstand der DNA-Methylierung sind und eine spezielle Häufigkeit und Verteilung aufweisen. Die CpG-Stellen bzw. -Dinukleotide sollten nicht mit den CpG-Inseln verwechselt werden. CpG-Inseln sind definierte Bereiche, in denen CpG-Stellen häufiger sind als in anderen Abschnitten des zugrunde liegenden Genoms.[1]
Zusammensetzung
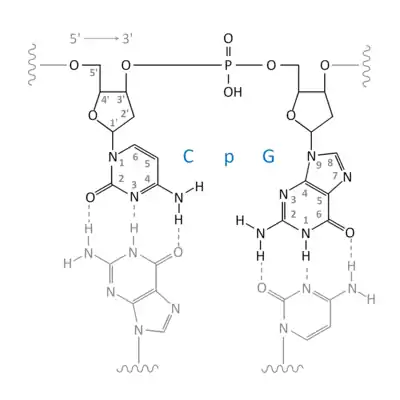
CpG ist innerhalb doppelsträngiger DNA eine Sequenz, die auf dem komplementären Strang in 5' – 3'-Richtung genauso lautet:
5' ... pNpNpNpCpGpNpNpN ... 3'
| | | | | | | |
3' ... NpNpNpGpCpNpNpNp ... 5'
(N: beliebige Nukleinbase)
Die chemische Zusammensetzung eines DNA-internen CpG-Motivs ist nebenstehend schematisch dargestellt.
Verteilung des CpG-Motivs
Da vier Nukleobasen (A, C, G und T) in der DNA vertreten sind, ergeben sich 4 * 4 = 16 verschiedene Zwei-Basen-Sequenzmotive (ApA, ApC, ...,CpG, ..., GpC, ..., TpG, TpT). Das CpG-Motiv unterscheidet sich von den anderen 15 Zwei-Basen-Motiven dadurch, dass es in der doppelsträngigen DNA verschiedener Lebewesen, darunter des Menschen, eine andere Verteilung und biologische Funktion besitzt als die sonstigen Zwei-Basen-Motive. Das CpG-Motiv kommt dort in CpG-Inseln statistisch gehäuft vor und kann unterschiedlich methyliert sein.[1] [2] [3] [4] [5] Die DNA-Methylierung führt vom Cytosin zum 5-Methylcytosin (Guanosin wird nicht methyliert). Der Methylierungsgrad von CpG-Stellen, insbesondere in den CpG-Inseln, beeinflusst die Genregulation und andere epigenetische Eigenschaften.[6] [7] Die Methylierung von CpG-Stellen spielt für die Krebsforschung bzw. -behandlung eine entscheidende Rolle, da sie in Tumoren häufig gestört ist.[8]
Die niedrige statistische Häufigkeit von CG-Sequenzen liegt an der CG-Suppression.
Methyl-CpG-bindende Proteine
Methyl-CpG-binding domain protein 1 (Mbd1) bindet an methylierte CpG-Dinukleotide,[9] ebenso Kaiso, die Kaiso-like proteins und SRA domain proteins.[10]
Therapeutische Anwendungen
Adjuvante Wirkung bei Impfstoffen
Bei Bakterien haben CpG-Stellen häufig nicht die gleiche Verteilung, Methylierung und Bedeutung wie beim Menschen. Diese Unterschiede fremder DNA werden von der angeborenen Immunabwehr des Menschen (und der anderer Wirbeltiere) erkannt und manche Immunzellen werden aktiviert. Die entscheidende Rolle hierbei spielt der intrazelluläre Pattern-Recognition Receptor TLR-9.[11] Diese Eigenschaft der unmethylierten CpG-Motive lässt sich ausnutzen, um eine adjuvante Wirkung im Organismus zu erzielen. Es werden synthetisch hergestellte, nukleasestabile CpG-Oligonukleotide als Hilfsstoff (Adjuvans) in klinischen Studien bei der Therapie von Tumorerkrankungen (darunter Krebsimpfstoffe),[12] Infektionserkrankungen und Allergien getestet. Die Stabilität gegen Nukleasen wird durch eine Phosphorothioat-Modifikation erreicht, bei der ein Sauerstoffatom des Phosphatrestes durch ein Schwefelatom ersetzt wird.[13]
Gentherapie
Bei bakteriellen Plasmiden zur Gentherapie werden teilweise die CpG-Dinukleotide entfernt, um einen vorzeitigen Abbau des Plasmids zu vermeiden.[14]
Einzelnachweise
- M. Gardiner-Garden, M. Frommer: CpG islands in vertebrate genomes. In: Journal of molecular biology. Band 196, Nummer 2, Juli 1987, S. 261–282, PMID 3656447.
- R. Chatterjee, C. Vinson: CpG methylation recruits sequence specific transcription factors essential for tissue specific gene expression. In: Biochimica et Biophysica Acta. Band 1819, Nummer 7, Juli 2012, S. 763–770, doi:10.1016/j.bbagrm.2012.02.014, PMID 22387149, PMC 3371161 (freier Volltext).
- E. Scarano, M. Iaccarino, P. Grippo, E. Parisi: The heterogeneity of thymine methyl group origin in DNA pyrimidine isostichs of developing sea urchin embryos. In: Proceedings of the National Academy of Sciences. Band 57, Nummer 5, Mai 1967, S. 1394–1400, PMID 5231746, PMC 224485 (freier Volltext).
- K. Jabbari, G. Bernardi: Cytosine methylation and CpG, TpG (CpA) and TpA frequencies. In: Gene. Band 333, Mai 2004, S. 143–149, doi:10.1016/j.gene.2004.02.043, PMID 15177689.
- Z. Zhao, L. Han: CpG islands: algorithms and applications in methylation studies. In: Biochemical and biophysical research communications. Band 382, Nummer 4, Mai 2009, S. 643–645, doi:10.1016/j.bbrc.2009.03.076, PMID 19302978, PMC 2679166 (freier Volltext).
- A. M. Deaton, A. Bird: CpG islands and the regulation of transcription. In: Genes & development. Band 25, Nummer 10, Mai 2011, S. 1010–1022, doi:10.1101/gad.2037511, PMID 21576262, PMC 3093116 (freier Volltext).
- J. A. Law, S. E. Jacobsen: Establishing, maintaining and modifying DNA methylation patterns in plants and animals. In: Nature Reviews Genetics. Band 11, Nummer 3, März 2010, S. 204–220, doi:10.1038/nrg2719, PMID 20142834, PMC 3034103 (freier Volltext).
- D. Sproul, R. R. Meehan: Genomic insights into cancer-associated aberrant CpG island hypermethylation. In: Briefings in functional genomics. Band 12, Nummer 3, Mai 2013, S. 174–190, doi:10.1093/bfgp/els063, PMID 23341493, PMC 3662888 (freier Volltext).
- L. Li, B. F. Chen, W. Y. Chan: An epigenetic regulator: methyl-CpG-binding domain protein 1 (MBD1). In: International journal of molecular sciences. Band 16, Nummer 3, 2015, S. 5125–5140, doi:10.3390/ijms16035125, PMID 25751725, PMC 4394467 (freier Volltext).
- P. A. Defossez, I. Stancheva: Biological functions of methyl-CpG-binding proteins. In: Progress in molecular biology and translational science. Band 101, 2011, S. 377–398, doi:10.1016/B978-0-12-387685-0.00012-3, PMID 21507359.
- Z. G. Ramirez-Ortiz, C. A. Specht, J. P. Wang, C. K. Lee, D. C. Bartholomeu, R. T. Gazzinelli, S. M. Levitz: Toll-like receptor 9-dependent immune activation by unmethylated CpG motifs in Aspergillus fumigatus DNA. In: Infection and immunity. Band 76, Nummer 5, Mai 2008, S. 2123–2129, doi:10.1128/IAI.00047-08, PMID 18332208, PMC 2346696 (freier Volltext).
- H. Shirota, D. Tross, D. M. Klinman: CpG Oligonucleotides as Cancer Vaccine Adjuvants. In: Vaccines. Band 3, Nummer 2, 2015, S. 390–407, doi:10.3390/vaccines3020390, PMID 26343193, PMC 4494345 (freier Volltext).
- S. Rotenfußer u. a.: CpG-Oligonukleotide: Immuntherapie nach dem Muster bakterieller DNA. In: Deutsches Ärzteblatt 98, 2001, S. A981-A985.
- Y. Takahashi, M. Nishikawa, Y. Takakura: Development of safe and effective nonviral gene therapy by eliminating CpG motifs from plasmid DNA vector. In: Frontiers in bioscience (Scholar edition). Band 4, 2012, S. 133–141, PMID 22202048.