Chemoimmunkonjugat
Ein Chemoimmunkonjugat, auch Antikörper-Wirkstoff-Konjugat genannt, engl. Chemoimmunoconjugate, ist ein Immunkonjugat, das aus einer zellbindenden Komponente und einem Zytostatikum besteht. Chemoimmunkonjugate sind potenzielle Arzneistoffe, die vor allem in der Onkologie zur Behandlung von Krebserkrankungen, im Rahmen einer Krebsimmuntherapie, eingesetzt werden sollen.
Aufbau
Chemoimmunkonjugate bestehen aus zwei Hauptkomponenten. Eine Komponente ist dabei ein möglichst selektiv an Krebszellen bindendes Trägermolekül. Dies ist in den meisten Fällen ein monoklonaler Antikörper oder ein Fragment eines monoklonalen Antikörpers oder ein entsprechendes Antikörpermimetikum. Das Trägermolekül dient zum einen als Ligand zur Anbindung an die Zielstruktur (Target) auf der Zellmembran einer Krebszelle. Als Zielstrukturen dienen im Wesentlichen Tumorantigene oder tumorspezifische Rezeptoren, das heißt Proteine oder Glycoproteine, die idealisiert nur von Krebszellen an ihrer Zelloberfläche präsentiert (exprimiert) werden. Die andere Funktion des Trägermoleküls ist die Anbindung eines Zytostatikums – der zweiten Hauptkomponente eines Chemoimmunkonjugates.
Funktion
Die in der konventionellen Chemotherapie verwendeten Zytostatika wirken nicht tumorspezifisch. Ihr Wirkmechanismus basiert im Wesentlichen darauf, dass stark proliferierende Zellen – hauptsächlich Krebszellen – deutlich empfindlicher gegenüber zytotoxischen Substanzen sind, als die meisten anderen Körperzellen. Gesunde Körperzellen, die sich ebenfalls schnell teilen, werden mit zunehmender Dosis mehr und mehr mit zerstört, was die Dosis des Chemotherapeutikums limitiert.[1] Andererseits wäre eine möglichst hohe Dosis wünschenswert, um alle Krebszellen restlos zu zerstören. Als Konsequenz dieser geringen therapeutischen Breite werden häufig suboptimale Dosen an Chemotherapeutika verabreicht. Als Lösung dieses Dilemmas wurden schon in den 1980er Jahren Versuche mit Antikörpern durchgeführt, an die Chemotherapeutika kovalent gebunden wurden.[2] Wenn durch den Antikörper eine ausreichende Selektivität zu Krebszellen gegeben ist, kann so eine Anreicherung des Zytostatikums am Tumor, beziehungsweise auch an einzelnen Krebszellen, erreicht werden. Das gesunde Gewebe ist dadurch deutlich geringeren Wirkstoffmengen ausgesetzt. Die Gesamtdosis an Wirkstoff kann so gegebenenfalls auch deutlich erhöht werden.[3]
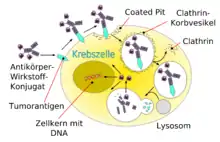
Die Krebszellen internalisieren die gebundenen Antikörper mittels rezeptorvermittelter Endozytose. Im Lysosom wird das Antikörper-Zytostatikum-Konjugat zerlegt und der Wirkstoff freigesetzt. Dieser kann dann beispielsweise die DNA der Krebszelle nachhaltig schädigen.[4][5] Die sonst bei der systemischen Gabe von Wirkstoffen zu beobachtenden Effekte der Multiple Drug Resistance, bei der Transporter, wie beispielsweise P-Glykoprotein (PGP), die Wirkstoffe wieder aus der Zelle ausschleusen, sind bei der antikörpervermittelten Gabe deutlich reduziert.[6][3]
Bei der Anbindung des Wirkstoffes an den Antikörper ist es wichtig, dass die chemische Bindung sowohl bei der Lagerung des Wirkstoffes – meist in gepufferter wässriger Lösung – als auch im Serum möglichst stabil ist, damit der Wirkstoff nicht unmittelbar nach der Injektion systemisch freigesetzt wird. Die Freisetzung soll idealerweise nur im Zellinneren oder gegebenenfalls in unmittelbarer Nähe der Krebszellen erfolgen. Als sogenannte Linker zwischen Antikörper und Wirkstoff werden im Wesentlichen Peptidsequenzen,[7][8] Hydrazone und Disulfide verwendet. Als Peptidsequenzen werden Strukturen verwendet, die durch lysosomale oder endosomale Enzyme (Proteasen) leicht gespalten werden können. Die Hydrazone sind säurelabil und werden durch niedrige pH-Werte (<5,0) geöffnet.[9] Bei den Disulfiden erfolgt die Freisetzung durch Disulfid-Austausch, beispielsweise durch Glutathion, das speziell in Krebszellen in hohen Konzentrationen vorhanden ist.[1] Die Glutathhion-Konzentration ist in malignen Zellen über eintausendmal höher als im Plasma.[10][3] Auf diese Weise können verschiedene Zytostatika, beispielsweise aus den Familien der Vincaalkaloide[11], der Folsäure-Antagonisten[12] oder der Anthracycline[13] an monoklonale Antikörper gebunden und in Tumorzellen freigesetzt werden.[3]
Um die Potenz des Konjugates zu erhöhen, wird meist mehr als ein Effektormolekül an den Antikörper gebunden. Die Anbindung am Antikörper erfolgt in den meisten Fällen nicht zielgerichtet, wodurch sich die Wahrscheinlichkeit erhöht, dass eines der Effektormoleküle im Bereich des Paratops des Antikörpers bindet und dadurch das Bindungsvermögen des Antikörpers an ein Epitop verloren geht. Die Anzahl der Effektormoleküle wird daher meist auf unter zehn Einheiten begrenzt. Ein Lösungsansatz dieser Problematik ist die Konjugation von verzweigten oder dendrimeren Effektor-Oligomeren am Antikörper. Dieses Prinzip wird beispielsweise auch bei Radioimmunkonjugaten angewendet.[14][15]
Beispiele
Eine Reihe von Chemoimmunkonjugaten befindet sich in der klinischen Prüfung. In vielen Fällen werden hochpotente Zytostatika, wie beispielsweise Doxorubicin, an monoklonale Antikörper gebunden, die bei der systemischen Gabe erhebliche Nebenwirkungen aufweisen. Im Beispiel von Doxorubicin ist dies die Kardiotoxizität dieser Verbindung. Andere an Antikörper konjugierte Zytostatika neben den bereits erwähnten Vincaalkaloiden[16], Antifolaten und Anthracyclinen, beispielsweise die Maytansinoide.[17][18] Auch α-Amanitin, das Hauptgift der Knollenblätterpilze, wird als Zytostatikum an Antikörper konjugiert.[19]
An Stelle von Antikörpern können auch Antikörper-Mimetika, wie beispielsweise Aptamere, verwendet werden.[20]
Abgrenzung
Bei der Chemo-Immuntherapie wird ein Chemotherapeutikum (wie beispielsweise 5-Fluoruracil) in einem Therapiezyklus zusammen mit einem Immuntherapeutikum (beispielsweise Interleukin-2) dem Patienten verabreicht. Das Chemotherapeutikum wird dabei auf konventionelle Weise systemisch verabreicht. Zusätzlich erhält der Patient ein Immuntherapeutikum, um möglichst alle Krebszellen abzutöten.
Immuntoxine sind im Aufbau den Chemoimmunkonjugaten sehr ähnlich, haben aber statt des Zytostatikums ein Toxin als Effektor.
Literatur
- R. V. Chari: Targeted cancer therapy: conferring specificity to cytotoxic drugs. In: Acc Chem Res 41, 2008, S. 98–107. PMID 17705444 (Review)
Einzelnachweise
- S. Jaracz u. a.: Recent advances in tumor-targeting anticancer drug conjugates. In: Bioorganic & Medicinal Chemistry 13, 2005, S. 5043–5054. PMID 15955702 (Review)
- J. R. Johnson u. a.: A vindesine-anti-CEA conjugate cytotoxic for human cancer cells in vitro. In: British Journal of Cancer 44, 1981, S. 472–475. PMID 7284242
- D. Scharma u. a.: Antibody targeted drugs as cancer therapeutics. In: Nature Reviews Drug Discovery 5, 2006, S. 147–159. PMID 16424916 (Review)
- M. C. Garnett: Targeted drug conjugates: principles and progress. In: Advanced Drug Delivery Reviews 53, 2001, S. 171–216. PMID 11731026 (Review)
- F. R. Maxfield und T. E. McGraw: Endocytic recycling. In: Nature Reviews Molecular Cell Biology 5, 2004, S. 121–132. PMID 15040445 (Review)
- V. Guillemard und S. H. Uri: Prodrug chemotherapeutics bypass p-glycoprotein resistance and kill tumors in vivo with high efficacy and targetdependent selectivity. In: Oncogene 23, 2004, S. 3613–3621. PMID 15034547
- S. O. Doronina u. a.: Development of potent monoclonal antibody auristatin conjugates for cancer therapy. In: Nature Biotechnology 21, 2003, S. 778–784. PMID 12778055
- L. M. Smith u. a.: Potent cytotoxicity of an auristatin-containing antibody-drug conjugate targeting melanoma cells expressing melanotransferrin/p97. In: Molecular Cancer Therapeutics 5, 2006, S. 1474–1482. PMID 16818506
- R. Haag und F. Kratz: Polymer therapeutics: concepts and applications. In: Angewandte Chemie Internationale Edition 45, 2006, S. 1198–1215. PMID 16444775
- I. Ojima: Guided molecular missiles for tumor-targeting chemotherapy - case studies using the second-generation taxoids as warheads. In: Accounts of Chemical Research 41, 2008, S. 108–119. PMID 17663526 (Review)
- D. A. Johnson und B. C. Laguzza: Antitumor xenograft activity with a conjugate of a Vinca derivative and the squamous carcinoma-reactive monoclonal antibody PF1/D. In: Cancer Research 47, 1987, S. 3118–3122. PMID 3495327
- W. C. Shen u. a.: Targeting, internalization, and cytotoxicity of methotrexate-monoclonal anti-stage-specific embryonic antigen-1 antibody conjugates in cultured F-9 teratocarcinoma cells. In: Cancer Research 46, 1986, S. 3912–3916. PMID 2873883
- R. O. Dillman u. a.: Superiority of an acid-labile daunorubicinmonoclonal antibody immunoconjugate compared to free drug. In: Cancer Research 48, 1988, S. 6097–6102. PMID 3262420
- C. Wängler u. a.: Antibody-dendrimer conjugates: the number, not the size of the dendrimers, determines the immunoreactivity. In: Bioconjug Chem 19, 2008, S. 813–820. PMID 1836151
- C. Wängler u. a.: Improved syntheses and applicability of different DOTA building blocks for multiply derivatized scaffolds. In: Bioorganic & Medicinal Chemistry 16, 2008, S. 2606–2616. PMID 18065226
- L. D. Apelgren u. a.: Chemoimmunoconjugate development for ovarian carcinoma therapy: preclinical studies with vinca alkaloid-monoclonal antibody constructs. In: Bioconjug Chem 4, 1993, S. 121–126. PMID 7873643
- H. K. Erikson: Antibody-Maytansinoid Conjugates Are Activated in Targeted Cancer Cells by Lysosomal Degradation and Linker-Dependent Intracellular Processing. In: Cancer Res 66, 2006, S. 4426–4433. PMID 16618769
- A. W. Tolcher u. a.: Cantuzumab Mertansine, a Maytansinoid Immunoconjugate Directed to the CanAg Antigen: A Phase I, Pharmacokinetic, and Biologic Correlative Study. In: Journal of Clinical Oncology 21, 2003, S. 211–222. PMID 12525512
- Stephen Parmley: Resurrecting a magic bullet. In: Science-Business eXchange. 7, 2014, doi:10.1038/scibx.2014.1397.
- Y. F. Huang u. a.: Molecular assembly of an aptamer-drug conjugate for targeted drug delivery to tumor cells. In: ChemBioChem 10, 2009, S. 862–868. PMID 19253922