CN-PAGE
Die Colorless Native Polyacrylamide Gel Electrophoresis (CN-PAGE, auf deutsch ‚farblose native Polyacrylamidgelelektrophorese‘) ist eine Variante der nativen Gelelektrophorese, bei der native, also gefaltete Proteine im elektrischen Feld durch die Gitterstruktur eines Polyacrylamid-Gels aufgetrennt werden.

Bei der Gelelektrophorese unter nativen Bedingungen geht es darum, die physiologischen Eigenschaften der aufzutrennenden Proteine zu erhalten. Dies kann mehrere Gründe haben, beispielsweise
- um Proteine aufzutrennen, die sich mit anderen Elektrophoreseverfahren nicht trennen lassen, wie phosphorylierte und nicht phosphorylierte Varianten desselben Proteins
- um biologisch relevante Konformationen aufzuzeigen, wie bei Proteinen, die als Monomere, Dimere, Trimere, Tetramere etc. auftreten können
- um eine Komplexbildung oder Protein-Protein-Interaktion verschiedener Proteine nachzuweisen
Durchführung
Anders als bei der SDS-PAGE, bei der Proteine in Anwesenheit von SDS unter Wärmezufuhr vollständig denaturiert werden und ihnen eine hohe Konzentration von negativen Ladungen angehängt wird, ist die Gelelektrophorese unter nativen Bedingungen ausschließlich auf die bestehenden Ladungen des Proteins angewiesen. Daher hängt die Wahl des Puffersystems vom isoelektrischen Punkt des Proteins ab. Ein Protein mit einem pI-Wert von 6,2 ist in einem Puffer mit pH 7 schwach negativ geladen und wandert daher im elektrischen Feld langsamer zur Anode als ein anderes Protein von pI 5. Stark basische Proteine (mit pI-Werten über 8) können in pH-neutralen Puffern aufgetrennt werden, indem man Anode und Kathode vertauscht.
Neben der Ladung der Proteine beeinflussen auch ihre Größe und Form die Wandereigenschaften. Um diese Faktoren zu minimieren, verwendet man häufig Polyacrylamidgele von niedriger Konzentration und Vernetzung, was andererseits ihre mechanische Stabilität verringert und die Handhabung erschwert.
Um die aufzutrennenden Proteine gefaltet zu halten, müssen der Puffer an die Erfordernisse der Proteine angepasst werden (reduzierende Agens etc.) und gegebenenfalls Kofaktoren (Nukleotide, Kationen etc.), die für Stabilität und Aktivität erforderlich sind, mit in den Puffer oder sogar in das Gel gegeben werden.
Um die bei der Aushärtungsreaktion des Polyacrylamidgels zugesetzten und entstehenden, eventuell störenden, Stoffe zu entfernen, und um die Ionen des Laufpuffers einwandern zu lassen, kann man das Gel vor dem Trennlauf eine Zeit lang ohne die zu trennende Probe elektrisch laufen lassen, und danach den Laufpuffer erneuern (engl. pre-run gels).
Einige Proteine benötigen zu ihrem Schutz eine geringe Konzentration an reduzierenden Verbindungen, wie zum Beispiel Dithioerythritol oder Mercaptoethanol. Solche Verbindungen können die Aushärtungsreaktion des Polyacrylamidgels entweder stören, oder selbst bei der Aushärtungsreaktion des Polyacrylamidgels zerstört werden. Das hinein Diffundieren von elektrisch neutralen Molekülen in das Gel würde sehr lange dauern. Deshalb kann man an Stelle der sonst üblichen elektrisch neutralen reduzierenden Verbindungen die ebenfalls Disulfidbrücken-reduzierende Aminosäure Cystein elektrophoretisch einwandern lassen. Der isoelektrische Punkt von Cystein liegt bei einem pH-Wert von 5,02. Bei diesem pH-Wert kann Cystein nicht in das Gel einwandern.
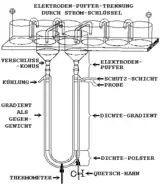
Bei vielen für die Nativ-Gelelektrophorese erforderlichen Puffersystemen entstehen an der Kathode stark basische und stark reduzierende Verbindungen, und an der Anode stark saure und stark oxidierende Verbindungen, wie zum Beispiel Hypochlorite. Um die Probe davor zu schützen, sollte man mehrere Elektrodenpuffergefäße verwenden, die durch mit Elektrodenpuffer gefüllte Stromschlüssel verbunden sind, wie es im oberen Teil des Bildes gezeigt wird, und zumindest den pH-Wert dieser Puffergefäße regelmäßig überprüfen.
Da bei der Gelelektrophorese Wärme entsteht und da die Wärmemenge vom Puffersystem abhängt, wird normalerweise unter Kühlung gearbeitet, gelegentlich werden die genauen Elektrophoresebedingungen auch sorgfältig ausgetestet.
Literatur
- Hermann Schägger, Gebhard von Jagow: Blue native electrophoresis for isolation of membrane protein complexes in enzymatically active form. In: Analytical Biochemistry. Bd. 199, Nr. 2, 1991, S. 223–231, PMID 1812789, doi:10.1016/0003-2697(91)90094-A.
- Hermann Schägger, W. A. Cramer, Gebhard von Jagow: Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. In: Analytical Biochemistry. Bd. 217, Nr. 2, 1994, S. 220–230, PMID 8203750, doi:10.1006/abio.1994.1112.
- Michael Niepmann, Junfeng Zheng: Discontinuous native protein gel electrophoresis. In: Electrophoresis. Bd. 27, Nr. 20, 2006, ISSN 0173-0835, S. 3949–3951, PMID 16991206, doi:10.1002/elps.200600172.