Bortrisulfid
Bortrisulfid ist eine anorganische chemische Verbindung des Bors aus der Gruppe der Sulfide.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
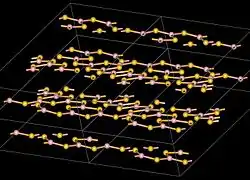 | |||||||||||||||||||
| _ B3+ _ S2− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Bortrisulfid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | B2S3 | ||||||||||||||||||
| Kurzbeschreibung |
schwach gelblicher Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 117,80 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
1,7 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Bortrisulfid kann durch Reaktion von Bor mit Schwefelwasserstoff gewonnen werden.[1]
Eigenschaften
Bortrisulfid ist ein schwach gelblicher äußerst hydrolyseempfindlicher Feststoff. Die amorphe Form hat keinen definierten Schmelzpunkt und beginnt bei etwa 300 °C zu sublimieren.[4] Er reagiert auch mit Alkoholen, Aminen und Mercaptanen.[1] Mit weiterem Schwefel reagiert die Verbindung bei 300 °C zu dem aus B8S16-Molekülen aufgebauten Bordisulfid BS2, dessen Struktur eng mit der des Porphins verwandt ist.[5]
Verwendung
Bortrisulfid wird für organische Synthesen verwendet. So reduziert es Sulfoxide zu Thiolen und reagiert mit Ketonen zu Thioketonen.[4]
Einzelnachweise
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 804.
- William M. Haynes: CRC Handbook of Chemistry and Physics, 93rd Edition. CRC Press, 2012, ISBN 1-4398-8049-2, S. 4–53 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Wiley-VCH: Ullmann's Fine Chemicals. John Wiley & Sons, 2013, ISBN 978-3-527-68357-4, S. 351 (eingeschränkte Vorschau in der Google-Buchsuche).
- Peter Paetzold: Chemie: Eine Einführung. Walter de Gruyter, 2009, ISBN 3-11-020268-9, S. 772 (eingeschränkte Vorschau in der Google-Buchsuche).