Born-Haber-Kreisprozess
Der Born-Haber-Kreisprozess (auch Born-Haber-Zyklus, 1916 von Fritz Haber und Max Born unabhängig voneinander gefunden[1]) verknüpft energetische Größen (Zustandsgrößen). Er ist eine direkte Folgerung aus dem Satz von Hess, nachdem die Reaktionsenthalpie unabhängig vom Reaktionsweg ist und lediglich vom Ausgangs- und Endzustand der Produkte und Edukte abhängt.[2] In einem solchen Kreisprozess kann jede Größe bestimmt werden, wenn die anderen bekannt sind. Dafür wird anstelle einer Reaktion eine Summe hypothetischer Teilschritte betrachtet, die einen alternativen und energiegleichen Reaktionsweg darstellen. Somit sind die Bestimmungen von nur schwer messbaren Größen wie der Gitterenergie von Ionenverbindungen, der Elektronenaffinität oder einer Ionisierungsenergie durch den Born-Haber-Kreisprozess möglich. Alle im Kreisprozess verwendeten Größen sind auf Stoffumsatz bezogene energetische Größen (Einheit: kJ pro mol). Der Kreisprozess ist also nichts anderes als eine Summe von Energien.[3] Die hypothetischen Teilschritte in genau dieser Reihenfolge als Gesamtreaktion im Labor durchzuführen ist nicht möglich. Durch experimentelles Bestimmen der einzelnen Werte können sie jedoch in einem Kreisschema aufgestellt werden. Wie alle Kreisprozesse beruht der Born-Haber-Kreisprozess auf dem 1. Hauptsatz der Thermodynamik.
Thermodynamische Begründung
Nach dem Satz von Hess muss die Gesamtsumme der Enthalpieänderungen Null sein.[4]
Durch Herausstellen der Standardbildungsenthalpie aus der Summe wird die Verknüpfung beider Enthalpiebilanzen sichtbar:
Durch Umstellen wird der Bezug zwischen Standardbildungsenthalpie und restlichen Reaktionsschritten deutlich:
Die Standardbildungsenthalpie entspricht folglich der Summe aller Teilschritte, wobei deren Vorzeichen umgedreht werden.
Die Summe aller Enthalpieänderungen der hypothetischen Teilschritte muss folglich gleich der Enthalpieänderung beim Bilden des Stoffs (unter Standardbedingungen) sein.[5] Sind die hypothetischen Reaktionsschritte aufgestellt, können sie umgestellt werden und die gewünschte Größe kann berechnet werden.
Aufstellen eines Schemas
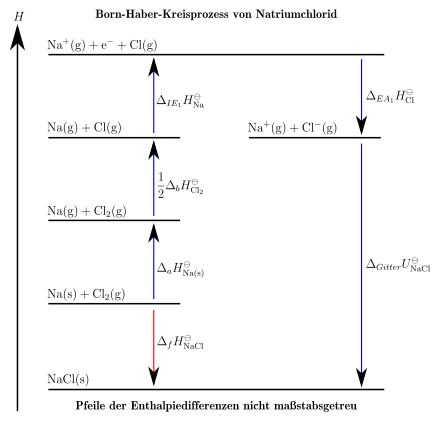
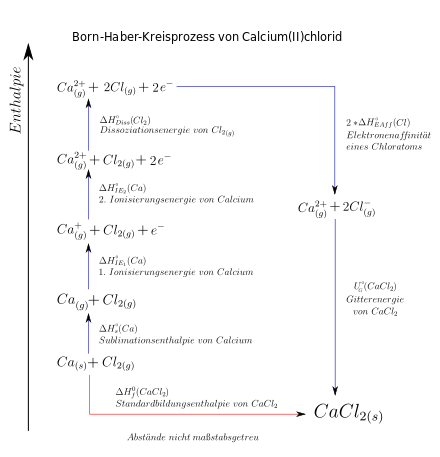
Im Folgenden soll die Aufstellung eines Kreisprozesses für Natriumchlorid aus festem Natrium und molekularem Chlor erläutert werden. Es soll die Gitterenergie von Natriumchlorid gesucht sein. Während Fachbegriffe wie 1. Ionisierungsenergie weitgehend vereinheitlicht sind, variieren die Buchstabenkürzel in der Literatur deutlich. Wichtig ist natürlich nur der zahlenmäßige Energiebetrag. Dieser ist auf eine Stoffmenge bezogen. Die Einheit ist folglich Kilojoule pro Mol.
- Einzeichnen einer vertikalen Enthalpieachse, um die Richtung von Enthalpieänderungen zu kennzeichnen. Bei der Vorzeichenkonvention existieren leider unterschiedliche Auffassungen zwischen Physik und Chemie. Generell muss die Änderung eines Systems betrachtet werden. In diesem Beispiel soll gelten: positive Vorzeichen vor den Teilschritten bewirken Erhöhung der Enthalpie (Pfeilrichtung), negative Vorzeichen bewirken Verringerung der Enthalpie. Enthalpieänderungen sollten mit Symbol und Energiebetrag gekennzeichnet werden.
- Das Produkt wird auf einer horizontalen Linie möglichst weit unten rechts eingezeichnet, um viel Platz nach Oben zu lassen. Im gesamten Prozess ist auf Aggregatzustände, Stöchiometrie und Elektronenkonfiguration Acht zu geben!
- Die Edukte und Chlorgas (Stöchiometrie beachten!) werden etwas höher links auf eine vertikale Linie aufgebracht. Ein Reaktionspfeil zum Reaktionsprodukt wird gezeichnet und als Standardbildungsenthalpie bzw. Reaktionsenthalpie beschriftet. Damit ist der normale Reaktionsweg aufgezeichnet. Nun gilt es die hypothetischen Teilschritte aufzuschreiben, die die Edukte (festes Natrium und Chlorgas) in denselben Zustand überführen würden.
- Zunächst muss das Natrium in die Gasphase gebracht werden. Dafür muss es sublimiert werden. Die dafür nötige Sublimationsenthalpie von Natrium beträgt +229 kJ pro mol. Die Edukte liegen nun höher auf der Enthalpieachse und werden dort eingezeichnet. Natrium ist nun wohlgemerkt gasförmig: .
- Nun muss die kovalente Bindung des Chlormoleküls homolytisch gespalten werden. Die Dissoziationsenergie von Chlor beträgt 242 kJ pro mol. Es entstehen 2 Chlorradikale. Der Energiebetrag muss jedoch aufgrund der Stöchiometrie halbiert werden, da nur ein Chloratom mit einem Natriumatom zu NaCl reagiert. Diese Chlorradikale befinden sich wie das Chlorgas immer noch in Gasphase. Die Edukte liegen wieder weiter oben auf der Enthalpieachse.
- Nun muss Natrium ionisiert werden, also das 3s-Elektron aus der Valenzschale herausgelöst werden um ein Natriumkation zu bilden. Dafür muss die 1. Ionisierungsenergie (also die Energie, um das 1. Elektron zu entfernen) von Natrium aufgebracht werden. beträgt +485 kJ pro mol. Die Stoffe liegen nun noch weiter oben. Das ausgelöste Elektron des Natriums wird weiterhin mitgeführt.
- Das vorher ausgelöste Elektron des Natriums wird nun von einem Chlorradikal aufgenommen. Es bildet sich ein Chloridanion. Der Energiebetrag der Elektronenaufnahme wird als Elektronenaffinität eines Chloratoms bezeichnet. Er beträgt −349 kJ pro mol. Dieser negative Energiebetrag bringt die Stoffe wieder auf ein niedrigeres Enthalpieniveau. Natrium liegt nun als und Chlorid als vor.
- Das Natriumkation und das Chloridanion trennen sich in ihrer Energie von festem Natriumchlorid nur noch im Betrag der Gitterenergie von Natriumchlorid. Diese ist gesucht. Ein beschrifteter Pfeil zum schließt den Kreisprozess.
Aus dem oben aufgestellten Kreisprozess ergibt sich die Energiesumme:
Durch Umstellen nach der gesuchten Gitterenergie erhält man:
Beim Umstellen und Einsetzen ist auf die Vorzeichen zu achten! Das Einsetzen von Literaturwerten ergibt:
Die so berechnete Gitterenergie beträgt:
was den Literaturwerten zwischen [7] bis sehr nahe kommt.
Alternative Darstellungen
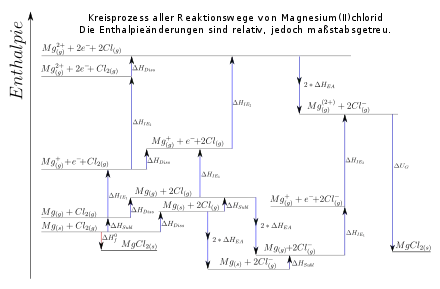
Solange das Prinzip des Satzes von Hess und der Energieerhaltung nicht gebrochen wird, sind auch andere Darstellungsformen erlaubt. Manche Darstellungen bevorzugen das Fehlen einer Enthalpieachse. Andere Formen stellen alle eventuellen Reaktionswege auf einmal dar, indem sie alle Edukte in allen Aggregatzuständen und sonstigen Zuständen angegeben.
Aussagequalität
Man kann auch Voraussagen über Stabilitäten von bisher unbekannten Verbindungen machen, zum Beispiel von solchen mit hohen Oxidationszahlen. Auch die damals noch unbekannten Edelgasverbindungen wurden über Stabilitätsabschätzungen mit Hilfe des Born-Haber-Kreisprozesses bereits vor ihrer Synthese als stabil vorausgesagt.
Kritik
Die Genauigkeit berechneter Werte hängt von der Messgenauigkeit aller anderen Werte ab. Eine gewisse Unsicherheit beruht darauf, dass einige Werte nur schwer mit durchschnittlicher Ausstattung präzise bestimmbar sind. Eine Vielzahl von Werten ist jedoch tabelliert und kann der Literatur entnommen werden. Die Gitterenergie lässt sich meist noch genauer mit der Born-Landé-Gleichung ermitteln.
Siehe auch
Einzelnachweise
- E. Müller, Ulrich Mortimer: "Chemie - Das Basiswissen der Chemie" (10. Auflage), Seite 98, ISBN 978-3-13-484310-1.
- Erwin Riedel, Christoph Janik: "Riedel – Anorganische Chemie" (8. Auflage), Seite 92, Verlag: De Gruyter Studium. ISBN 978-3-11-022566-2.
- Lesley E.Smart, Elaine A.Moore. "Solid State Chemistry". Third Edition (2005), Seite 97, ISBN 0-203-49635-3.
- http://www.chemieunterricht.de/dc2/tip/04_00.htm
- Michael Binnewies, Manfred Jäckel, Helge Willner, Georg Rayner-Canham. "Allgemeine und Anorganische Chemie". Spektrum Akademischer Verlag Heidelberg - Berlin, 1. Auflage 2004, Seite 128, ISBN 3-8274-0208-5.
- http://www.chemgapedia.de/vsengine/vlu/vsc/de/ch/11/aac/vorlesung/kap_4/vlu/gitterenergie.vlu/Page/vsc/de/ch/11/aac/vorlesung/kap_4/kap4_4/kap44_2/kap442_1.vscml.html
- Archivlink (Memento vom 15. November 2016 im Internet Archive)