Blockierte Isocyanate
Die Begriffe Blockierte Isocyanate bzw. Verkappte Isocyanate beschreiben den Umstand, dass Additionsverbindungen von hochreaktiven Isocyanaten mit Alkoholen (Urethane) und Aminen (Harnstoffe) bei höheren Temperaturen diese Isocyanate wieder freisetzen können.[1] Diese Reversibilität wird industriell bei der Herstellung von Polyurethan-Einbrennlacken ausgenutzt.
Eigenschaften
Blockierte Isocyanate entstehen durch Umsetzung von Isocyanaten mit H-aciden Verbindungen. Sie sind thermisch instabil und zersetzten sich (deblockieren) oberhalb von etwa 120 °C wieder zu Isocyanaten. Sie reagieren erst bei Erhitzung weiter, wodurch sich der Zeitpunkt der Reaktion besser steuern lässt und eine lange Lagerfähigkeit der Lacke gewährleistet wird. Blockierte Isocyanate werden außer als Vernetzer für Lacke und Beschichtungen auch als Flexibilisator in Epoxidsystemen eingesetzt. Diese Produkte basieren auf flexiblen Polyurethan-Prepolymeren, die mit Phenol blockiert sind. Die Deblockierung findet durch Reaktion mit dem Aminhärter statt, so dass ein Harnstoff entsteht, der in das Epoxidnetzwerk eingebaut wird und als Weichsegment fungiert.
Es werden Blockierungsmittel mit verschiedenen Deblockierungstemperaturen eingesetzt. Die Temperatur ist jedoch auch von der chemischen Struktur des Isocyanates und der Flüchtigkeit des Blockierungsmittels abhängig. Zinn- und Bismut-Verbindungen senken die Deblockierungstemperatur um einige Grad Celsius.[2]
| Blockierungsmittel | Deblockierungstemperatur [°C] | Blockierungsmittelrestmenge bei 30 min Einbrennzeit |
|---|---|---|
| Acetessigsäure, Malonester (z. B. Malonsäurediethylester) | 120–130 | |
| 3,5-Dimethylpyrazol | 140 | 14 % |
| Butanonoxim | 150 | 27 % |
| sekundäre Amine | 120–160 | |
| Caprolactam, Phenole | 160–180 | |
| Alkohole | >180 |
KTL-Beschichtung
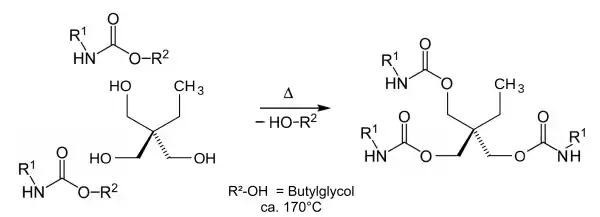
In der Automobilindustrie werden beispielsweise zur KTL-Beschichtung der Metallkarossen wässrige Gemische von Epoxyamin-Addukten[3] (als deren Formiate) und Bisisocyanat-Butylglycol-Urethanen eingesetzt. Typischerweise werden bei den Bisisocyanat-Butylglycol-Urethanen die Bisisocyanate „TDI“ oder „MDI“ verwendet, ein geringer Anteil an Bisisocyanat-Trimethylolpropan-Urethan sorgt für eine spätere Quervernetzung.
Nach kataphoretischer Abscheidung dieses Gemischs auf der leitenden Metalloberfläche bei circa 200 Volt folgt in einem zweiten Schritt das „Einbrennen“ bei circa 180 °C.[4] Hierbei spaltet des „verkappte Bisisocyanat“ thermisch Butylglycol (Siedepunkt 171 °C) ab und beim Abkühlen addiert das reaktive Diisocyanat die Hydroxyfunktionen der Epoxyamin-Addukte und Trimethylolpropans. Es entsteht eine schlagfeste und spiegelglatte Polyurethan-Erstbeschichtung der Metallkarosse von circa 20 µm Schichtdicke, die danach weitere Kunstharzbeschichtungen erhält. Spuren von Silikon-haltigen Substanzen beeinträchtigen die Oberflächenqualität extrem.
Allophanat-Bildung
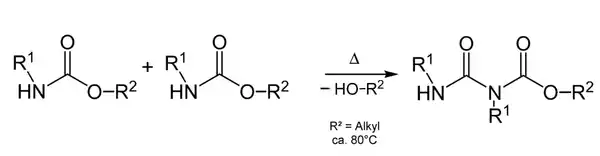
Urethane können ab ca. 80–90 °C eine schleichende exotherme Polykondensation einleiten. Hierbei addiert sich das „verkappte Isocyanat“ an den Amid-Stickstoff eines zweiten Urethan-Moleküls. Der Mechanismus entspricht dem der Biuret-Bildung.
Harnstoff
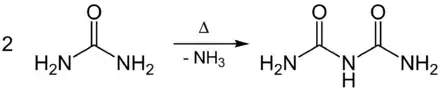
Auch Harnstoff verhält sich wie ein verkapptes Isocyanat. Noch vor Erreichen seines Schmelzpunkts findet eine Ammoniak-Abspaltung ab 130 °C statt. Die resultierende hochreaktive Isocyansäure addiert sich an ein weiteres Harnstoff-Molekül und es entsteht Biuret (Carbamoylharnstoff) sowie in Spuren auch Triuret.
Einzelnachweise
- E. Delebecq, J. P. Pascault, B. Boutevin, F. Ganachaud: On the versatility of urethane/urea bonds: reversibility, blocked isocyanate, and non-isocyanate polyurethane. In: Chemical Reviews. Band 113, Nummer 1, Januar 2013, S. 80–118. doi:10.1021/cr300195n. PMID 23082894.
- Eintrag zu blockierte Isocyanate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. Januar 2014.
- Überwiegend aus Bisphenol-A-bisglycidylether [MG ca. 400] und Diethanolamin
- KTL-Tauchlackierung, mit Bild einer Brennkammer für Autokarossen