Binimetinib
Binimetinib ist ein Arzneistoff, der angewendet wird zur Behandlung des Melanoms („schwarzer Hautkrebs“), wenn eine bestimmte genetische Veränderung vorliegt (Mutation im Wachstumsgen BRAF) und das Melanom operativ nicht entfernt werden kann oder in andere Körperteile gestreut (metastasiert) hat. Binimetinib wird dazu mit dem Wirkstoff Encorafenib kombiniert.
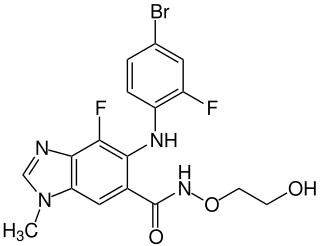
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Binimetinib | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C17H15BrF2N4O3 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L01XE41 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 441,23 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Im Juni 2018 hat die US-amerikanische Zulassungsbehörde (FDA) Binimetinib in Kombination mit Encorafenib zugelassen.[2] Der Ausschuss für Humanarzneimittel der europäischen Arzneimittelagentur empfahl im Juli 2018 die Zulassung,[3] die EU-Zulassung folgte im September 2018.[4][5]
Binimetinib gehört zur Gruppe der Proteinkinaseinhibitoren beziehungsweise MEK-Inhibitoren, die die Kinaseaktivität der mitogen-aktivierten extrazellulär signalregulierten Kinasen 1 (MEK1) und 2 (MEK2) hemmen.[6]
Klinische Angaben
Anwendungsgebiete
Binimetinib – in Kombination mit Encorafenib[7][8][9] – ist angezeigt zur Behandlung von Erwachsenen mit nicht-resezierbarem (d. h. nicht operablem) oder metastasiertem Melanom mit einer BRAF-V600-Mutation.[5][10][11][12]
Art und Dauer der Anwendung
Binimetinib ist oral wirksam, die empfohlene Gesamttagesdosis von Binimetinib beträgt 90 mg. Die Behandlung sollte weitergeführt werden, bis der Patient keinen Nutzen mehr davon hat oder eine inakzeptable Toxizität auftritt.[5]
Besondere Patientengruppen
Vor der Einnahme von Binimetinib in Kombination mit Encorafenib muss bei den Patienten eine BRAF-V600-Mutation mittels eines validen Tests nachgewiesen worden sein.
Der BRAF-Mutationstest (BRAF-Assay) kann Tumore mit der BRAF-Mutation identifizieren und soll ihr mögliches Ansprechen auf BRAF-Inhibitoren wie z. B. Encorafenib einzuschätzen helfen. Die Testung kann mittels DNA-basierten Methoden oder mittels Immunhistochemie für die häufigste Mutation (BRAF-V600E) erfolgen.[13][14]
Die Wirksamkeit und Sicherheit von Binimetinib in Kombination mit Encorafenib wurde nur für Patienten mit Tumoren, die eine BRAF V600E und V600K Mutation exprimieren, belegt. Binimetinib in Kombination mit Encorafenib darf nicht bei Patienten mit einem malignen Melanom vom BRAF-Wildtyp angewendet werden.[5]
Unerwünschte Wirkungen
Die folgenden Ereignisse wurden unter der Kombinationstherapie mit Encorafenib und Binimetinib in der Standarddosierung sehr häufig (das heißt bei mehr als einem von 10 Behandelten) beobachtet: Anämie, periphere Neuropathie, Schwindelgefühl, Kopfschmerzen, Sehstörungen, Ablösung retinales Pigmentepithel, Blutungen, Hypertonie, Abdominalschmerz, Diarrhoe, Erbrechen, Übelkeit, Obstipation, Hyperkeratose, Hautausschlag, trockene Haut, Pruritus, Alopezie, Arthralgie, Muskelerkrankungen / Myalgie, Rückenschmerzen, Schmerzen in den Extremitäten, Pyrexie, peripheres Ödem, Fatigue, Anstieg Kreatinkinase im Blut, Anstieg Transaminasen, Anstieg Gamma-Glutamyl-Transferase.[5]
Pharmakologische Eigenschaften
Wirkungsmechanismus
Binimetinib ist ein nicht-ATP-kompetitiver, reversibler Inhibitor der Kinaseaktivität der mitogen-aktivierten extrazellulär signalregulierten Kinase 1 (MEK1) und MEK2. In einem zellfreien System hemmt Binimetinib MEK1 und MEK2 mit halb-maximalen inhibitorischen Konzentrationen (IC50) von 12-46 nM. Die MEK-Proteine sind vorgeschaltete Regulatoren des mit extrazellulären Signalen verbundenen Kinase-Signalübertragungswegs (ERK), der die Zellproliferation fördert. Beim Melanom und anderen Krebsarten ist dieser Signalweg oft aktiviert durch mutierte Formen von BRAF, die MEK aktivieren. Binimetinib hemmt die Aktivierung von MEK durch BRAF sowie die MEK-Kinaseaktivität. Binimetinib hemmt das Wachstum von Melanom-Zelllinien mit BRAF-V600-Mutation und zeigt Antitumor-Wirkungen in Tiermodellen mit BRAF-V600-mutiertem Melanom.[5]
Für die etwa 20 Prozent der Melanome mit NRAS-Mutationen kann Binimetinib ebenfalls angewendet werden.[15]
Da Binimetinib und Encorafenib beide den MAP-Kinase-Signalweg hemmen, bewirkt die kombinierte Gabe eine höhere Antitumor-Aktivität. Darüber hinaus verhinderte die Kombination Encorafenib plus Binimetinib in vivo bei humanen Melanom-Xenografts mit BRAF-V600E-Mutation die Entwicklung einer Resistenz.
Binimetinib erhöht zusammen mit Encorafenib gegenüber der BRAF-Inhibitor-Monotherapie die Wirksamkeit bei adäquater Verträglichkeit.[16][17][18][19]
Aufnahme und Verteilung im Körper
Nach wiederholter zweimal täglicher Gabe zusammen mit Encorafenib wurden Steady-State-Bedingungen für Binimetinib innerhalb von 15 Tagen ohne größere Akkumulation erreicht. Die mittlere (CV %) Cmax,ss betrug 654 ng/ml (34,7 %) und der Mittelwert der AUCss 2,35 μg·h/ml (28,0 %) in Kombination mit Encorafenib, wie per Populations-PK-Modell geschätzt. Die Pharmakokinetik von Binimetinib verhält sich in etwa dosislinear.[5]
Die Resorption von Binimetinib erfolgt rasch mit einer medianen Tmax von 1,5 Stunden. Die Einnahme von Binimetinib ist mit und ohne Nahrung möglich. Die Ausscheidung erfolgt zu 62,3 % über die Fäzes und zu 31,4 % über den Urin; die mediane terminale Halbwertszeit beträgt 8,66 Stunden.[5]
Studien
COLUMBUS (Zulassungsstudie): Die Sicherheit und Wirksamkeit von Encorafenib in Kombination mit Binimetinib wurde in einer 2-teiligen, randomisierten, wirkstoff-kontrollierten, offenen, multi-zentrischen Phase-III-Studie (CMEK162B2301) in Patienten mit nicht-resezierbarem oder metastasiertem Melanom mit BRAF-V600E- oder -K-Mutation untersucht, die mittels BRAF-Assay festgestellt wurden. Die Patienten hatten ein histologisch bestätigtes kutanes Melanom oder ein histologisch bestätigtes Melanom mit unbekanntem Primärtumor; Patienten mit Aderhaut- oder Schleimhautmelanom waren von der Studienteilnahme ausgeschlossen worden. Eine vorherige adjuvante Therapie sowie eine vorherige Immuntherapie-Linie zur Behandlung der nicht-resezierbaren, lokal fortgeschrittenen oder metastasierten Erkrankung waren zulässig. Eine vorherige Behandlung mit BRAF-/MEK-Inhibitoren war nicht zulässig.[20]
Für die Zulassung war insbesondere der Teil 1 der COLUMBUS-Studie relevant. In diesem Studienteil wurden 577 Patienten im Verhältnis 1:1:1 in die folgenden 3 Behandlungsarme randomisiert: Encorafenib 450 mg einmal täglich plus Binimetinib 45 mg zweimal täglich; Encorafenib 300 mg einmal täglich; Vemurafenib 960 mg zweimal täglich. Die Phase-III-Studie zeigte – laut unabhängigem zentralem Review, dass die Kombination von Encorafenib 450 mg einmal täglich und Binimetinib 45 mg zweimal täglich das progressionsfreie Überleben (PFS) im Vergleich zur Vemurafenib-Monotherapie 960 mg zweimal täglich signifikant verbessert (Median 14,9 versus 7,3 Monate; Hazard Ratio [HR]=0,54; 95 % Konfidenzintervall [KI]: 0,41-0,71; p < 0,0001). Das PFS war der primäre Endpunkt der Studie.[17]
Im September 2018 in The Lancet Oncology publizierte Daten zeigen, dass die Behandlung mit Encorafenib + Binimetinib – als sekundärer Endpunkt der Studie – ein medianes Gesamtüberleben (OS) von 33,6 Monaten erzielte, im Vergleich zu 16,9 Monaten für Patienten, die mit Vemurafenib als Monotherapie behandelt wurden (HR=0,61; 95 % KI: 0,47-0,79; nominelles p < 0,0001).[18]
Frühe Nutzenbewertung
In Deutschland müssen seit 2011 neu zugelassene Medikamente mit neuen Wirkstoffen gemäß § 35a SGB V einer „frühen Nutzenbewertung“ durch den Gemeinsamen Bundesausschuss (G-BA) unterzogen werden, wenn der pharmazeutische Hersteller einen höheren Verkaufspreis als nur den Festbetrag erzielen möchte. Nur wenn ein Zusatznutzen besteht, kann der Arzneimittelhersteller mit dem Spitzenverband der gesetzlichen Krankenkassen einen Preis aushandeln. Die Dossierbewertungen, auf deren Basis der G-BA seine Beschlüsse fasst, erstellt das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG).
Die Kombination von Binimetinib mit Encorafenib zur Behandlung von erwachsenen Patienten mit nicht-resezierbarem oder metastasiertem Melanom mit einer BRAF-V600-Mutation wurde 2018 bzw. 2019 bewertet.[21][22] Gemäß G-BA-Beschluss ist ein Zusatznutzen gegenüber der zweckmäßigen Vergleichstherapie weder für vorbehandelte noch für nicht vorbehandelte Betroffene belegt.[23]
Handelsnamen
Der Handelsname des Monopräparat von Binimetinib ist Mektovi vom Hersteller Pierre Fabre.
Binimetinib wird in Kombination mit Encorafenib (Braftovi) gegeben.
Literatur
- Ernst Mutschler et al.: Mutschler – Arzneimittelwirkungen Lehrbuch der Pharmakologie und Toxikologie. 10. Auflage. Wissenschaftl. Verlagsgesellschaft, Stuttgart 2012, ISBN 978-3-8047-2898-1.
Weblinks
- Hautkrebs: Basaliome, Plattenepithelkarzinome, maligne Melanome. Krebsinformationsdienst, Februar 2013.
- Hautkrebs. Entwicklungen und Trends in der Onkologie
Einzelnachweise
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 1H-Benzimidazole-6-carboxamide, 5-[(4-bromo-2-fluorophenyl)amino]-4-fluoro-N-(2-hydroxyethoxy)-1-methyl- im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 22. Oktober 2018.
- Center for Drug Evaluation and Research: Approved Drugs - FDA approves encorafenib and binimetinib in combination for unresectable or metastatic melanoma with BRAF mutations. In: www.fda.gov. Abgerufen am 28. Juni 2018.
- Mektovi - binimetinib Summary of opinion (initial authorisation). (PDF) Pressemitteilung EMA, 26. Juli 2018; abgerufen am 21. Oktober 2018.
- EMA: Mektovi, EPAR der EMA (englisch), abgerufen am 21. Oktober 2018.
- EMA: Zusammenfassung des Arzneimittels (PDF; 743 kB) abgerufen am 21. Oktober 2018.
- P Koelblinger et al.: A review of binimetinib for the treatment of mutant cutaneous melanoma. In: Future Oncology. Band 13, Nr. 20, August 2017, S. 1755–1766, doi:10.2217/fon-2017-0170, PMID 28587477.
- Community register of medicinal products for human use - Mektovi. European Commission; abgerufen am 21. Oktober 2018.
- Community register of medicinal products for human use - Braftovi. European Commission; abgerufen am 21. Oktober 2018.
- Mektovi ( binimetinib) - An overview of Mektovi and why it is authorised in the EU (PDF) EMA; abgerufen am 21. Oktober 2018.
- Community register of medicinal products for human use - Mektovi. European Commission; abgerufen am 21. Oktober 2018.
- Community register of medicinal products for human use - Braftovi. European Commission; abgerufen am 21. Oktober 2018.
- Mektovi (binimetinib) - An overview of Mektovi and why it is authorised in the EU. (PDF) EMA; abgerufen am 21. Oktober 2018.
- D. Capper, A. S. Berghoff, M. Magerle, A. Ilhan, A. Wöhrer, M. Hackl, J. Pichler, S. Pusch, J. Meyer, A. Habel, P. Petzelbauer, P. Birner, A. von Deimling, M. Preusser: Immunohistochemical testing of BRAF V600E status in 1,120 tumor tissue samples of patients with brain metastases. In: Acta Neuropathol. 123(2), Feb 2012, S. 223–233. doi:10.1007/s00401-011-0887-y.
- D. Capper, M. Preusser, A. Habel, F. Sahm, U. Ackermann, G. Schindler, S. Pusch, G. Mechtersheimer, H. Zentgraf, A. von Deimling: Assessment of BRAF V600E mutation status by immunohistochemistry with a mutation-specific monoclonal antibody. In: Acta Neuropathol. 122(1), Jul 2011, S. 11–19. doi:10.1007/s00401-011-0841-z.
- Malignes Melanom: Durchbruch in der Therapie. In: Deutsches Ärzteblatt, 2014, 111(45), S. [24]; abgerufen am 25. Oktober 2018.
- Fachinformation Mektovi. (PDF; 560 kB) fachinfo.de; abgerufen am 21. Oktober 2018.
- R Dummer et al.: Encorafenib plus binimetinib versus vemurafenib or encorafenib in patients with BRAF-mutant melanoma (COLUMBUS): a multicentre, open-label, randomised phase 3 trial. In: The Lancet Oncology. Band 19, Nr. 5, Mai 2018, S. 603–615, doi:10.1016/S1470-2045(18)30142-6, PMID 29573941.
- R Dummer et al.: Overall survival in patients with BRAF-mutant melanoma receiving encorafenib plus binimetinib versus vemurafenib or encorafenib (COLUMBUS): a multicentre, open-label, randomised, phase 3 trial. In: The Lancet Oncology. Band 19, Nr. 10, Oktober 2018, S. 1315–1327, doi:10.1016/S1470-2045(18)30497-2, PMID 30219628.
- P Koelblinger et al.: Development of encorafenib for BRAF-mutated advanced melanoma. In: Current Opinion in Oncology. Band 30, Nr. 2, März 2018, S. 125–133, doi:10.1097/CCO.0000000000000426, PMID 29356698, PMC 5815646 (freier Volltext).
- Study Comparing Combination of LGX818 Plus MEK162 Versus Vemurafenib and LGX818 Monotherapy in BRAF Mutant Melanoma (COLUMBUS). ClinicalTrials.gov; abgerufen am 21. Oktober 2018.
- A18-62 Binimetinib (Melanom) - Nutzenbewertung gemäß § 35a SGB V. iqwig.de; abgerufen am 25. März 2020.
- A19-18 Binimetinib (Melanom) - Addendum zum Auftrag A18-62. iqwig.de; abgerufen am 25. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Binimetinib (Melanom, BRAF-V600-Mutation, Kombination mit Encorafenib). g-ba.de; abgerufen am 25. März 2020.