Bariumferrat(VI)
Bariumferrat(VI) ist eine chemische Verbindung mit der Formel BaFeO4. Sie enthält Eisen in seiner höchstwertigen derzeit bekannten Oxidationsstufe +6. Bariumferrat ist isomorph mit Bariumsulfat (BaSO4) und enthält das Ferrat-Ion FeO42−, in dem das Eisen tetraedrisch von vier Sauerstoffatomen umgeben ist.[4]
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
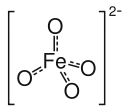 | |||||||
| Allgemeines | |||||||
| Name | Bariumferrat(VI) | ||||||
| Summenformel | BaFeO4 | ||||||
| Kurzbeschreibung |
rotvioletter Feststoff[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 257,17 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Löslichkeit |
nahezu unlöslich in Wasser[2] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Geschichte
Bariumferrat wurde erstmals 1843 von Heinrich Rose hergestellt und untersucht,[5] weitere Forschungen wurden 1871 von J. de Mollins[6] und L. Moeser 1897 durchgeführt.[7]
Darstellung

Ferrate werden allgemein durch Oxidation einer Eisenverbindung oder elementaren Eisens mittels eines starken Oxidationsmittels erhalten. So kann durch Glühen von Eisen mit Kaliumnitrat Kaliumferrat erhalten werden[8], das nach dem Abkühlen durch Auslaugen in Eiswasser gelöst werden kann. Die Reaktion verläuft nicht quantitativ, es werden dabei auch Eisenoxide gebildet, die sich als unlöslicher Rückstand am Boden des Gefäßes absetzen. Aus dem Filtrat dieser Lösung muss das Ferrat sofort mit Bariumchlorid als Bariumferrat gefällt werden, da es sich sonst rasch zersetzt. Der Niederschlag wird zuerst mit Wasser, dann mit aldehydfreiem Ethanol gewaschen und anschließend im Vakuumexsikkator getrocknet.[1][9]
- Darstellung von Kaliumferrat aus Eisen und Kaliumnitrat durch Glühen
- Fällen von Bariumferrat mittels Bariumnitrat
Eigenschaften
Bariumferrat tritt als Monohydrat BaFeO4·H2O auf.[10]
Bariumferrat ist wie alle Ferrate ein starkes Oxidationsmittel, das beispielsweise die Permanganate in ihrer Oxidationskraft übertrifft (Normalpotential für Fe3+/FeO42− bei pH 0: 2,2 V; bei pH 14: 0,55 V)[11]. Im sauren Bereich reagiert das Ferrat-Ion sofort mit Wasser unter Abscheidung von Eisen(III)-oxid und Sauerstoff.[11]
Einzelnachweise
- Jander Blasius, Anorganische Chemie 2, 16. Auflage, 2011. Seite 314. ISBN 978-3-7776-2133-3.
- Physical characteristics, electrochemical behaviour and stability of barium ferrate. doi:10.1016/j.electacta.2004.03.013.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Longman A-level course in chemistry, 4th Edition, 2005. ISBN 9814105082.
- H. Rose: "Ueber die Zusammensetzung der Eisensäure" in Pogg. Ann, 1843, 59, S. 315–325. Volltext.
- J. de Mollins, in Berichte der deutschen chemischen Gesellschaft, 1871, 4, S. 626–627. Volltext.
- L. Moeser: "Zur Kenntniss der eisensauren Salze" in Journal für Praktische Chemie, 1897, 56 (1), S. 425–437. doi:10.1002/prac.18970560133.
- G. W. Thompson, L. T. Ockerman, J. M. Schreyer: "Preparation and Purification of Potassium Ferrate. VI" in J. Am. Chem. Soc., 1951, 73 (3), S. 1379–1381. doi:10.1021/ja01147a536.
- J. R. Gump, W. F. Wagner, J. M. Schreyer: "Preparation and Analysis of Barium Ferrate(VI)" in Anal. Chem., 1954, 26 (12), S. 1957. doi:10.1021/ac60096a027.
- H. Firouzabadi, D. Mohajer, M. Entezari-moghaddam: "Barium Ferrate Monohydrate BaFeO4·H2O, A Versatile Reagent for the Oxidation of Organic Compounds under Aprotic Condition" in Synthetic Communications: An International Journal for Rapid Communication of Synthetic Organic Chemistry, 1986, 16 (6), S. 723–731. doi:10.1080/00397918608057745.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1646–1665.