Bariumcarbid
Bariumcarbid ist eine chemische Verbindung des Bariums aus der Gruppe der Carbide. Neben BaC2 ist mit BaC6 mindestens ein weiteres Bariumcarbid bekannt.[2]
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
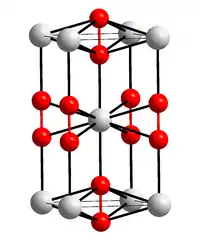 | ||||||||||
| _ Ba2+ _–_ C≡C2− | ||||||||||
| Allgemeines | ||||||||||
| Name | Bariumcarbid | |||||||||
| Andere Namen |
Bariumacetylid | |||||||||
| Verhältnisformel | BaC2 | |||||||||
| Kurzbeschreibung |
grauer Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 161,35 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Dichte |
3,74 g·cm−3[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
Zersetzung in Wasser und Säuren[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
Bariumcarbid kann durch Reaktion von Barium mit Kohlenstoff bei 1300 °C gewonnen werden.[4]
Ebenfalls möglich ist die Darstellung aus Bariumsulfat mit rotem Phosphor und Kohlenstoff.[5]
Eigenschaften
Bariumcarbid gehört in der Gruppe der Carbide zu den Acetyliden, da es formal vom Ethin abgeleitet ist. Es ist ein grauer Feststoff, der mit Wasser unter Abgabe von Ethin reagiert.[1]
Es sind mehrere Modifikationen bekannt, wobei die tetragonale Form unter 150 °C stabil ist.[2] Sie kristallisiert in der Raumgruppe I4/mmm (Raumgruppen-Nr. 139) mit den Gitterparametern a = 439,4 pm und b = 712,5 pm. Das Ba2+-Ion wird dabei von jeweils beiden Kohlenstoffatomen vier benachbarter C22−-Ionen und von jeweils einem Kohlenstoffatom zweier weiterer Anionen koordiniert.[6] Bei 769 °C geht die tetragonale Form in eine kubische Phase mit der Raumgruppe Fm3m (Nr. 225) über, unterhalb von −100 °C bildet sich eine monokline Phase mit der Raumgruppe C2/c (Nr. 15).[6]
Einzelnachweise
- Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2011, ISBN 978-1-4398-1461-1, S. 499 (eingeschränkte Vorschau in der Google-Buchsuche).
- Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 978-0-444-59550-8, S. 358 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- seilnacht.com: Seilnachts Periodensystem: Barium, abgerufen am 13. Dezember 2014
- R. K. Sharma: Chemistry Of Hydrides And Carbides. Discovery Publishing House, 2007, ISBN 978-81-8356-227-0, S. 295 (eingeschränkte Vorschau in der Google-Buchsuche).
- V. Vohn, W. Kockelmann, U. Ruschewitz: On the synthesis and crystal structure of BaC2. In: Journal of Alloys and Compounds, 284, 1999, S. 132–137, doi:10.1016/S0925-8388(98)00957-8.