Bacteriocine
Bacteriocine sind proteinöse Toxine, die von Bakterienstämmen abgesondert werden und das Wachstum anderer Stämme derselben oder ähnlicher Bakterienarten hemmen (inhibieren). Man schätzt, dass 99 % aller Bakterien mindestens ein Bakteriocin produzieren und ausscheiden. Im Gegensatz zu den meist niedermolekularen Antibiotika sind Bacteriocine Peptide oder Proteine.[1] Ihre genetische Information ist dabei auf Plasmiden kodiert.[2] Im Gegensatz zu den nichtribosomalen Peptiden mit ähnlicher Wirkung wie Polymyxine und Iturine werden Bakteriocine am Ribosom erzeugt.[3]
Als erste Bacteriocine wurden Colicine 1925 von André Gratia in Escherichia coli beschrieben.[4][5][6]
Physiologische Rolle
Bacteriocine haben meist ein schmales Wirkspektrum, insbesondere zur Minderung der Nährstoffkonkurrenz auf Arten beschränkt, die dem Erzeugerorganismus ähnlich sind. Bacteriocine mit Breitbandwirkung sind Nisin aus Lactococcus lactis[7][8] und Reutericyclin (aus Lactobacillus reuteri).[9] Bakteriocine spielen eine Rolle in der Eroberung und Verteidigung ökologischer Nischen gegen verwandte Bakterienstämme. Auch bei Infektionskrankheiten verwenden Bakterien Bakteriocine als Wettbewerbsstrategie.[10]
Klassifizierung von Bacteriocinen
Bacteriocine können in verschiedene Kategorien unterteilt werden, beispielsweise nach Art des Erzeugerstammes, der Sekretion, des Wirkspektrums, des Ausmaßes der post-translationalen Modifikation sowie nach Wirk- und Resistenzmechanismus.
Bacteriocine von grampositiven Bakterien werden meist in eine der folgenden vier Klassen eingeteilt.[3] Bakteriocine der Klasse I und II sind relativ kleine, kationische, amphiphile, Biomembran-bindende Peptide zwischen drei und zehn Kilodalton.[3] Bakteriocine der Klasse I enthalten die die nichtkanonischen Aminosäuren Lanthionin and Methyllanthionin.[3] Bakteriocine der Klasse II werden weiter in drei Subtypen unterteilt: IIa umfasst gegen Listerien wirksame Peptide mit der N-terminalen Aminosäuresequenz YGNGVXCI, IIb heterodimere Bakteriocine, und IIc Thiol-aktivierte Bakteriocine.[3] Bakteriocine der Klasse III besitzen eine Masse über 30 Kilodalton und sind hitzelabil.[3] Bakteriocine der Klasse IV besitzen für die Funktion notwendige Lipide oder Glykosylierungen.[3]
Bacteriocine von gramnegativen Bakterien werden meist der Größe nach in drei Gruppen klassifiziert, die aber auch genetische, strukturelle und funktionelle Ähnlichkeiten erfasst. Die Mikrocine sind Peptide oder kleine Proteine bis zu einer Größe von ca. 20 kDa. CLBs, von Colicin-like bacteriocins (deutsch: Colicin-ähnliche Bakteriocine), sind zwischen 20 und 90 kDa groß. Colicine sind Bakteriocine des Bakteriums Escherichia coli. Ähnliche Bakteriocine kommen aber auch in anderen Gram negativen Bakterien vor. Sie können basierend auf ihren zytotoxischen Mechanismen oder basierend auf ihren Importmechanismen (Gruppe A und B) weiter unterteilt werden.[11] Tailocine sind große Bacteriocine, die aus mehreren Untereinheiten bestehen und den Schwanzstrukturen von Bakteriophagen ähneln. Am besten erforscht wurden die Tailocine von Pseudomonas aeruginosa, die weiter in F- und R-Typ Pyocine unterteilt werden.[12]
Abgrenzung
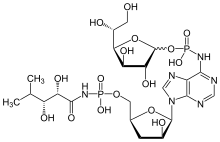
Einige andere, als Bacteriocine mit Breitbandwirkung beschriebene, meist niedermolekulare Substanzen mit antimikrobiellen Eigenschaften, etwa das von Lactobacillus reuteri produzierte Reuterin[13] zählen im engeren Sinn nicht zu den Bacteriocinen, da sie nicht von Proteasen gespalten werden und daher keine Peptide bzw. Proteine sind.[14]
Anwendung
Manche Bacteriocine sind für die Lebensmittelindustrie interessant. So kann man Nisin, von Milchsäurebakterien synthetisiert, als Konservierungsmittel in verschiedenen Produkten wie Streichkäse verwenden.[2] Die Verwendung von Bakteriocinen als Antibiotika ist im Gespräch.[15][16][17][18]
Beispiele
- Alveicin
- Aureocin
- Aureocin A53
- Aureocin A70
- Bisin
- Carnocin
- Carnocyclin
- Caseicin
- Cerein
- Circularin A
- Colicine aus Colibakterien,
- Curvaticin
- Divercin
- Duramycin aus Streptomyces,
- Enterocin
- Enterolysin
- Epidermin/gallidermin
- Erwiniocin
- Gardimycin
- Gassericin A[33]
- Glycinecin
- Halocin
- Haloduracin
- Lactocin S[34]
- Lactococcin
- Lacticin
- Lantibiotika aus verschiedenen Staphylokokken, die Lanthionin und Methyllanthionin enthalten,[1]
- Leucoccin
- Lysostaphin
- Macedocin
- Mersacidin
- Mesentericin
- Microbisporicin
- Microcin S
- Mutacin
- Nisin aus dem Milchsäurebakterium Lactococcus lactis.
- Paenibacillin
- Planosporicin
- Pediocin
- Pentocin
- Plantaricin
- Pneumocyclicin
- Pyocine
- Reutericin 6
- Sakacin
- Salivaricin
- Sublancin
- Subtilin
- Sulfolobicin
- Syringacine 4-C und W-1 aus Pseudomonas syringae pv. syringae[19]
- Tasmancin
- Thuricin 17
- Trifolitoxin
- Variacin
- Vibriocin
- Warnericin
- Warnerin
Siehe auch
- Archaeocine – von Archaeen synthetisierte antimikrobielle Peptide und Proteine
- Eucaryocine – von Eukaryoten synthetisierte antimikrobielle Peptide und Proteine
- Mikrobizide
Einzelnachweise
- Institut für Medizinische Mikrobiologie, Immunologie und Parasitologie: Bacteriocine – Lantibiotika (Memento vom 11. November 2013 im Internet Archive), Universität Bonn.
- Richard F. Shand, Kathryn J. Leyva: Archaeal Antimicrobials: An undiscovered country. In: Paul Blum (Hrsg.): Archaea: New Models for Prokaryotic Biology. Caister Academic Press, 2008, ISBN 978-1-904455-27-1, S. 233f.
- H. Lee, H. Y. Kim: Lantibiotics, class I bacteriocins from the genus Bacillus. In: Journal of microbiology and biotechnology. Band 21, Nummer 3, März 2011, ISSN 1738-8872, S. 229–235. PMID 21464591.
- A. Gratia: Sur un remarquable exemple d'antagonisme entre deux souches de colibacille. In: Compt. Rend. Soc. Biol. Band 93, 1925, S. 1040–1042.
- J. P. Gratia: Andre Gratia: a forerunner in microbial and viral genetics. In: Genetics. Band 156, Nr. 2, 2000, S. 471–6. PMID 11014798. PMC 1461273 (freier Volltext)
- Definition bei UniProt
- K. A. Stevens u. a.: Nisin treatment for inactivation of Salmonella species and other gram-negative bacteria. In: Applied and Environmental Microbiology. Band 57, Nr. 12, 1991, S. 3613–3615.
- E. Breukink, B. de Kruijff: The lantibiotic nisin, a special case or not? In: Biochimica et Biophysica Acta. Band 1462, Nummer 1–2, Dezember 1999, ISSN 0006-3002, S. 223–234. PMID 10590310.
- Eintrag zu Reutericyclin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. November 2013.
- Kathryn E Holt u. a.: Tracking the Establishment of Local Endemic Populations of an Emergent Enteric Pathogen. In: Proceedings of the National Academy of Sciences. 110.43, 2013, S. 17522–17527. doi:10.1073/pnas.1308632110.
- Eric Cascales u. a.: Colicin Biology. In: Microbiology and Molecular Biology Reviews. 71.1, 2007, S. 158–229. doi:10.1128/MMBR.00036-06.
- Maarten G K Ghequire, René De Mot: Ribosomally Encoded Antibacterial Proteins and Peptides from Pseudomonas. In: FEMS Microbiology Reviews. 38.4, 2014, S. 523–568. doi:10.1111/1574-6976.12079
- L. T. Axelsson, T. C. Chung, W. J. Dobrogosz, S. E. Lindgren: Production of a Broad Spectrum Antimicrobial Substance by Lactobacillus reuteri. In: Microbial Ecology in Health and Disease. Vol. 2, No. 2, 1989, S. 131–136. doi:10.3109/08910608909140210.
- Eintrag zu Reuterin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. November 2013.
- Manuel Montalbán-López u. a.: Are Bacteriocins Underexploited? NOVEL Applications for OLD Antimicrobials. In: Current Pharmaceutical Biotechnology. 12, 2011, S. 1205–1220.
- Samira Soltani, Riadh Hammami, Paul D Cotter, Sylvie Rebuffat, Laila Ben Said: Bacteriocins as a new generation of antimicrobials: toxicity aspects and regulations. In: FEMS Microbiology Reviews. Band 45, Nr. 1, 8. Januar 2021, ISSN 1574-6976, S. fuaa039, doi:10.1093/femsre/fuaa039, PMID 32876664, PMC 7794045 (freier Volltext) – (oup.com [abgerufen am 12. Juli 2021]).
- Shih-Chun Yang, Chih-Hung Lin, Calvin T. Sung, Jia-You Fang: Antibacterial activities of bacteriocins: application in foods and pharmaceuticals. In: Frontiers in Microbiology. Band 5, 26. Mai 2014, ISSN 1664-302X, doi:10.3389/fmicb.2014.00241, PMID 24904554, PMC 4033612 (freier Volltext) – (frontiersin.org [abgerufen am 12. Juli 2021]).
- B. Kirkup: Bacteriocins as Oral and Gastrointestinal Antibiotics: Theoretical Considerations, Applied Research, and Practical Applications. In: Current Medicinal Chemistry. Band 13, Nr. 27, 1. November 2006, S. 3335–3350, doi:10.2174/092986706778773068 (eurekaselect.com [abgerufen am 12. Juli 2021]).
- P. Lavermiocca, S. L. Lonigro, F. Valerio, A. Evidente, A. Visconti: Reduction of Olive Knot Disease by a Bacteriocin from Pseudomonas syringae pv. ciccaronei. In: Applied and environmental Microbiology. Vol 68, No. 3, 2002, S. 1403–1407. PMC 123734 (freier Volltext)