Allotrope Formen von Sauerstoff
Es existieren mehrere allotrope Formen von Sauerstoff.
Sauerstoff ist ein typisches Nichtmetall. Es besteht im gasförmigen Zustand aus einzelnen Molekülen. Das Element bildet dabei mehrere Allotrope, die nach der Anzahl Sauerstoffatome zu unterscheiden sind. Die häufigste Form des Sauerstoffs ist der Disauerstoff O2. Weitere Allotrope sind Ozon O3 sowie die seltenen Allotrope Tetrasauerstoff O4 und Oktasauerstoff O8.
Hochdruckphasen von Sauerstoff
Bei Raumtemperatur und Drücken größer 10 GPa wandelt sich Sauerstoff, bestehend aus O2-Molekülen, in einen roten Feststoff um. Diese Phase, die anscheinend ein weiteres Allotrop neben Disauerstoff (O2) und Ozon (O3) darstellt, wird auch ε-Sauerstoff oder roter Sauerstoff genannt. Ursprünglich wurde aufgrund infrarotspektroskopischer Untersuchungen im Jahr 1999 angenommen, dass es sich hierbei um Tetrasauerstoff O4 handelt. Kristallographische Analysen des roten Sauerstoffs aus dem Jahr 2006 deuten jedoch auf neuartige O8-Aggregate, die sich aber von den S8-Ringen des Schwefels unterscheiden.[1] Bei 4800 °C und 96 GPa tritt ein Phasenübergang zum ζ-Sauerstoff auf, der elektrisch leitend ist und in dieser metallischen Form wahrscheinlich im Inneren der Gasplaneten Jupiter und Saturn vorliegt.
Tetrasauerstoff
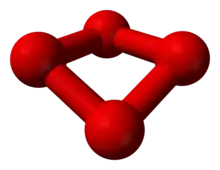
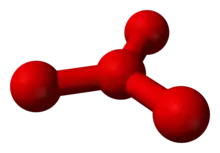
Schon seit 1911 gab es erste Hinweise auf die Existenz von O4, das auch als Oxozon bezeichnet wurde und womöglich bei der Ozonherstellung nach Carl Dietrich Harries entstand. Die damals beobachteten Additionen von vier Sauerstoffatomen an einzelne Doppelbindungen organischer Verbindungen legten das vorübergehende Vorhandensein von O4 nahe. Auch wurde Tetrasauerstoff 1924 von Gilbert Newton Lewis vorhergesagt, um damit das Versagen des Curieschen Gesetzes für flüssigen Sauerstoff erklären zu können. Tatsächlich wurden O4-Aggregate schon in flüssigem Sauerstoff nachgewiesen. Doch sind diese als (O2)2 aufzufassen, welche aus zwei O2-Molekülen bestehen und mit einer Dissoziationsenergie von 0,54 kJ/mol sehr instabil sind.
Mittels Massenspektrometrie konnte Tetrasauerstoff 2001 indirekt nachgewiesen werden. Dabei wurden zunächst O2-Moleküle und positiv geladene O2-Ionen zu O4-Ionen kombiniert, deren Existenz die Massenspektrometrie zeigen konnte. Anschließend wurden die Ionen durch Aufnahme von Elektronen in neutrale O4-Moleküle umgewandelt, die nicht direkt im Massenspektrometer nachgewiesen werden können. Doch da nach einer Reionisierung wieder die O4-Ionen auftraten, müssen zwischenzeitlich auch stabile, neutrale O4-Moleküle existiert haben. Theoretische Berechnungen sprachen bisher entweder für ein Dreieck aus Sauerstoffatomen mit einem vierten Atom im Zentrum, oder für ein rautenförmiges Molekül. Die dargestellten Ergebnisse deuten auch darauf hin, dass die vier Sauerstoffatome zwei hantelförmige O2-Moleküle mit lockerer Bindung zueinander bilden könnten. Die Zusammenlagerung der beiden O2-Moleküle beruht auf der Besetzung von zwei bindenden Molekülorbitalen (MO), die neben zwei antibindenden MOs aus vier entarteten π*-Orbitalen entstanden sind und durch zwei Elektronenpaare mit antiparallelem Spin besetzt sind (HOMO und HOMO-1).
Eine mögliche technische Anwendung aufgrund der hohen Energiedichte von O4 könnte die Nutzung als eine Komponente in Raketentreibstoffen sein. Dabei wird erwartet, dass die Verbrennung mit Wasserstoff oder Kohlenwasserstoffen noch effektiver ist als bei flüssigem O2[2].
In dem Fernerkundungsverfahren Differenzielle optische Absorptionsspektroskopie wird ausgenutzt, dass der Stoßkomplex O4 proportional zum Quadrat der bekannten Sauerstoffkonzentration vorkommt. Über die Absorptionsstrukturen von O4 ist es dann möglich, Rückschlüsse auf atmosphärische Eigenschaften zu ziehen.
Oktasauerstoff
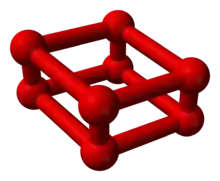
Gestützt auf infrarotspektroskopische Messungen wurde seit 1999 angenommen, dass es sich bei ε-Sauerstoff um Tetrasauerstoffmoleküle, also O4 handelt. Jedoch konnten neuere kristallographische Studien die Existenz von O8-Aggregaten im ε-Sauerstoff nachweisen. Die O8-Struktur unterscheidet sich aber von den kronenförmigen S8-Ringen des Schwefels und ähnelt einem etwas zusammengedrückten Würfel, bei dem jeweils zwei Sauerstoffatome an den vier verkürzten Kanten sitzen. Die Bindungen in den O2-Einheiten betragen 120 Pikometer (pm) und entsprechen damit der Bindungslänge von molekularem Sauerstoff unter Normalbedingungen (121 pm), während die Abstände in den O4-Ringen mit 219 pm deutlich kleiner als der Van-der-Waals-Abstand von 304 pm für Sauerstoff sind. Auch die kurzen Abstände von ca. 260 pm zwischen den O8-Quadern deuten auf bindende Wechselwirkungen hin.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 504.
- F. Cacace, G. De Petris, A. Troiani: Experimental Detection of Tetraoxygen. In: Angewandte Chemie (International ed. in English). Band 40, Nummer 21, November 2001, S. 4062–4065, ISSN 1521-3773. PMID 12404493. doi:10.1002/1521-3773(20011105)40:21<4062::AID-ANIE4062>3.0.CO;2-X.
Weblinks
- Darstellung des Oxozons 1911 (en)
- Infrarotspektrum von rotem Sauerstoff (en)
- Flüssiger Sauerstoff wird bei hohem Druck ein Metall. Auf: wissenschaft.de vom 9. April 2001
- Kristallographische Analyse des ε-Sauerstoffs (en)
- Experimenteller Nachweis von Oktasauerstoff (en)
- O8 Cluster in the ε Phase of Solid Oxygen
Einzelnachweise
- Ralf Steudel, Ming Wah Wong (2007): Dunkelrote O8-Moleküle in festem Sauerstoff: rhombusförmige Cluster statt S8-ähnlicher Ringe. Angewandte Chemie, 119 (11), 1798–1801.
- Nature News: New form of oxygen found. doi:10.1038/news011122-3