Aclidiniumbromid
Aclidiniumbromid ist ein Arzneistoff aus der Gruppe der Anticholinergika und wird verwendet, um die verengten Atemwege bei Erwachsenen mit chronisch obstruktiver Lungenerkrankung (COPD) zu erweitern. Die Anwendung erfolgt inhalativ mittels eines Pulverinhalators.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
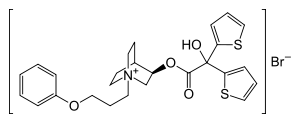 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Aclidiniumbromid | ||||||||||||||||||
| Andere Namen |
(3R)-3-[(Hydroxy)di(thiophen-2-yl)acetyloxy]-1-(3-phenoxypropyl)-1λ5-azabicyclo[2.2.2]octan-1-yliumbromid | ||||||||||||||||||
| Summenformel | C26H30BrNO4S2 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
R03BB05 | ||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 564,55 g·mol−1 | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Wirkungsmechanismus
Aclidiniumbromid wirkt als Antagonist insbesondere am Muskarinrezeptor M3, an dem es, verglichen mit den vier anderen Muskarinrezeptoren (M1, M2, M4 und M5), eine längere Bindungsdauer aufweist. M3-Rezeptoren regeln die Kontraktion der glatten Muskulatur der Luftwege. Durch die M3-Rezeptorblockade mit Aclidiniumbromid entsteht eine lang andauernde Hemmung der acetylcholinvermittelten Bronchienverengung.
Nur ein sehr geringer Teil, nämlich unter 5 % der inhalierten Dosis, gelangt unverändert in den systemischen Blutkreislauf. Diese niedrige Bioverfügbarkeit hat ihre Ursache in einer raschen und umfänglichen systemischen und präsystemischen Hydrolyse des Wirkstoffs.
Anwendungsgebiet
Aclidiniumbromid ist als Pulver zur Inhalation seit Juli 2012 in der EU unter den Namen Bretaris Genuair und Eklira Genuair (Almirall, S.A.) zugelassen zur symptomatischen, bronchodilatatorischen Dauertherapie bei Erwachsenen mit chronisch-obstruktiver Lungenerkrankung (COPD).
Frühe Nutzenbewertung
In Deutschland müssen seit 2011 neu zugelassene Medikamente mit neuen Wirkstoffen gemäß § 35a SGB V einer „frühen Nutzenbewertung“ durch den Gemeinsamen Bundesausschuss (G-BA) unterzogen werden, wenn der pharmazeutische Hersteller einen höheren Verkaufspreis als nur den Festbetrag erzielen möchte. Nur wenn ein Zusatznutzen besteht, kann der Arzneimittelhersteller mit dem Spitzenverband der gesetzlichen Krankenkassen einen Preis aushandeln. Die Dossierbewertungen, auf deren Basis der G-BA seine Beschlüsse fasst, erstellt das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG).
Der erste G-BA-Beschluss vom 21. März 2013 wurde durch ein weiteres Nutzenbewertungsverfahren aufgehoben.[2] 2016 wurde Aclidimiumbromid für Erwachsene mit COPD ab einem mittleren Schweregrad mit dem langwirksamen Beta-2-Sympathomimetikum Formoterol verglichen; für Betroffene mit darüberhinausgehenden Schweregraden legte der Hersteller keine Studiendaten vor.[3] Gemäß G-BA-Beschluss ist für Patienten mit Schweregrad II, für Patienten mit Schweregrad IV und unter zwei Exazerbationen pro Jahr sowie bei darüberhinausgehenden Schweregraden mit mindestens zwei Exazerbationen pro Jahr ein Zusatznutzen nicht belegt. Für Betroffene mit Schweregrad III und unter zwei Exazerbationen pro Jahr gibt es dagegen einen Hinweis auf einen beträchtlichen Zusatznutzen.[4]
In einem weiteren Bewertungsverfahren wurde die Aclidiniumbromid in Kombination mit Formoterol verglichen mit Formoterol alleine bzw. bei einer über einen mittleren Schweregrad hinausgehenden COPD und mindestens zwei Exazerbationen pro Jahr mit Formoterol sowie einem inhalativen Kortikosteroid.[5] Gemäß G-BA-Beschluss gibt es für Patienten mit COPD und unter zwei Exazerbationen im Jahr bei Schweregrad II einen Hinweis auf einen geringen Zusatznutzen und bei Schweregrad III einen Hinweis für einen beträchtlichen Zusatznutzen. Für Betroffene mit unter zwei Exazerbationen im Jahr und Schweregrad IV sowie für Betroffene mit mindestens zwei Exazerbationen und Schweregrad III oder IV ist ein Zusatznutzen nicht belegt.[6]
Nebenwirkungen und Anwendungsbeschränkungen
Die häufigsten Nebenwirkungen, die bei bis zu 1 von 10 Behandelten beobachtet wurden, sind Kopfschmerzen, Entzündung der Nasennebenhöhlen (Sinusitis), Rhinopharyngitis, Husten und Durchfall. Eine sehr vorsichtige Anwendung ist angebracht bei Patienten mit vorangegangenen bestimmten Erkrankungen des Herz-Kreislauf-Systems (vorangegangener Herzinfarkt, instabile Angina Pectoris, Arrhythmie, Krankenhauseinweisung aufgrund einer Herzinsuffizienz der Stadien NYHA III und IV), ebenso bei Patienten mit symptomatischer Prostatavergrößerung, mit Harnabflussbehinderung im Blasenhals oder einem Engwinkelglaukom.
Aclidiniumbromid und seine Metaboliten zeigten in in-vitro-Studien weder Hemmung noch Anregung von CYP450-Enzymen oder Esterasen; auch sind sie keine Substrate oder Inhibitoren von P-Glykoprotein, so dass Anwendungsbeschränkungen über solche Wechselwirkungen nicht zu erwarten sind.
Chemisch-physikalische Informationen
Aclidiniumbromid hat ein chirales Zentrum, die pharmakologisch aktive Form ist das (R)-Enantiomer. Aclidiniumbromid ist ein kristallines Pulver und sehr schwach löslich in Wasser oder Ethanol.
Präparate
- Monopräparate: Eklira Genuair (AstraZeneca), Bretaris Genuair (Berlin-Chemie)
- Kombinationspräparate aus Aclidinium und Formoterol: Duaklir (AstraZeneca), Brimica (Berlin-Chemie)
Weblinks
- Neue Arzneistoffe 2012: Aclidiniumbromid, Eklira® Genuair® (Allmiral). In: Pharmazeutische Zeitung online.
- Informationen (Öffentlicher Beurteilungebericht, Fachinformation, Packungsbeilage) zu Bretaris Genuair. auf der Website der europäischen Arzneimittelagentur.
Einzelnachweise
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Aclidinium bromide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 16. November 2019.
- Nutzenbewertungsverfahren zum Wirkstoff Aclidiniumbromid – Beschluss aufgehoben. g-ba.de; abgerufen am 23. März 2020.
- A15-45 Aclidiniumbromid – Nutzenbewertung gemäß § 35a SGB V. iqwig.de; abgerufen am 23. März 2020
- Nutzenbewertungsverfahren zum Wirkstoff Aclidiniumbromid (Erneute Nutzenbewertung § 14: COPD). iqwig.de; abgerufen am 23. März 2020.
- A15-06 Aclidinium/Formoterol – Nutzenbewertung gemäß § 35a SGB V (Dossierbewertung). iqwig.de; abgerufen am 23. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Aclidiniumbromid/Formoterol (COPD). iqwig.de; abgerufen am 23. März 2020.