Acetyl-CoA-Acetyltransferase
Acetyl-CoA-Acetyltransferase (ACAT) (auch: 3-Ketothiolase oder Thiolase II) heißen Enzyme, die die Acetylierung von Acetyl-Coenzym A und die Umkehrreaktion katalysieren. Diese Reaktionen sind zum Auf- und Abbau von Ketokörpern notwendig, aber auch in der Biosynthese der Steroide und beim Abbau mancher Aminosäuren. ACAT kommt in allen Lebewesen, und in Eukaryoten in zwei Kopien vor, einer im Zytosol (ACAT2) und einer in den Mitochondrien (ACAT1). Defekte im ACAT1-Gen sind wahrscheinlich mit einer seltenen Stoffwechselkrankheit assoziiert,[1] dem Beta-Ketothiolase-Mangel.[2]
| Acetyl-CoA-Acetyltransferase | ||
|---|---|---|
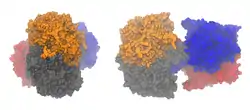 | ||
| Oberflächenmodelle des ACAT1-Tetramers (von oben, seitlich) nach PDB 2IBW | ||
| Masse/Länge Primärstruktur | ca. 395 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homotetramer | |
| Kofaktor | Kalium | |
| Bezeichner | ||
| Gen-Name(n) | ACAT1, ACAT2 | |
| Enzymklassifikation | ||
| EC, Kategorie | 2.3.1.9, Transferase | |
| Reaktionsart | Übertragung einer Acetylgruppe | |
| Substrat | 2 Acetyl-CoA | |
| Produkte | CoA + Acetoacetyl-CoA | |
ACAT1-Varianten waren in einer chinesischen Studie mit veränderten LDL- und nHDL-Cholesterin-Werten assoziiert. Eine ähnliche Beobachtung wurde zuvor in einer japanischen Studie gemacht. ACAT in Macrophagen scheint allerdings eine wichtige Rolle bei der Kontrolle der Lipide in Schaumzellen zu spielen.[3][4][5][6]
Katalysiertes Gleichgewicht
2 ![]() ⇔ CoA-SH +
⇔ CoA-SH + ![]()
Zwei Moleküle Acetyl-CoA werden zu Coenzym A und Acetoacetyl-CoA umgesetzt und umgekehrt.
Weblinks
- reactome.org: 2 acetyl-CoA ⇔ acetoacetyl-CoA+CoA
Einzelnachweise
- UniProt P24752, UniProt Q9BWD1
- Alpha-methylacetoacetic aciduria. In: Online Mendelian Inheritance in Man. (englisch)
- Li Q, Bai H, Fan P: [Analysis of acyl-coenzyme A: cholesterol acyltransferase 1 polymorphism in patients with endogenous hypertriglyceridemia in Chinese population]. In: Zhonghua Yi Xue Yi Chuan Xue Za Zhi. 25, Nr. 2, April 2008, S. 206–10. PMID 18393248.
- Ohta T, Takata K, Katsuren K, Fukuyama S: The influence of the acyl-CoA:cholesterol acyltransferase-1 gene (-77G → A) polymorphisms on plasma lipid and apolipoprotein levels in normolipidemic and hyperlipidemic subjects. In: Biochim. Biophys. Acta. 1682, Nr. 1–3, Juni 2004, S. 56–62. doi:10.1016/j.bbalip.2004.01.008. PMID 15158756.
- Su YR, Dove DE, Major AS, et al: Reduced ABCA1-mediated cholesterol efflux and accelerated atherosclerosis in apolipoprotein E-deficient mice lacking macrophage-derived ACAT1. In: Circulation. 111, Nr. 18, Mai 2005, S. 2373–81. doi:10.1161/01.CIR.0000164236.19860.13. PMID 15851589.
- Fazio S, Major AS, Swift LL, et al: Increased atherosclerosis in LDL receptor-null mice lacking ACAT1 in macrophages. In: J. Clin. Invest.. 107, Nr. 2, Januar 2001, S. 163–71. doi:10.1172/JCI10310. PMID 11160132. PMC 198874 (freier Volltext).