Abemaciclib
Abemaciclib ist ein Arzneistoff zur Behandlung bestimmter Formen des Brustkrebses. Er ist ein Vertreter der neuen Wirkstoffklasse der Cyclin-abhängigen Kinase-Inhibitoren und ist oral wirksam.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
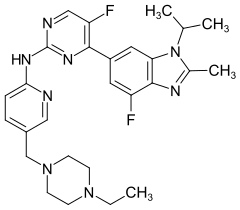 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Abemaciclib | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C27H32F2N8 | |||||||||||||||||||||
| Kurzbeschreibung |
CDK-Inhibitor[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L01XE50 | |||||||||||||||||||||
| Wirkstoffklasse |
Antineoplastikum | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 506,61 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Die Zulassung in den USA erfolgte am 28. September 2017 im Rahmen des beschleunigten Zulassungsverfahrens der FDA (Break Through Therapy),[3] in der Europäischen Union ein Jahr später am 27. September 2018.[4]
Anwendung
Abemaciclib wird gemeinsam mit Fulvestrant oder als Monotherapie für die Behandlung von HR-positivem, HER2-negativem oder metastasierendem Brustkrebs eingesetzt.[5]
Pharmakologie
Wirkungsmechanismus
Wie andere CDK-Inhibitoren hemmt Abemaciclib die cyclin-abhängigen Kinasen CDK4 und CDK6, welche – nach Aktivierung durch Bindung an Cyclin D – für die Phosphorylierung und somit Deaktivierung des Retinoblastom-Proteins, einem Tumorsuppressor, verantwortlich sind. Dies hat Auswirkungen auf den Zellzyklus während des Übergangs von der Phase G1 (Wachstumsphase) zur Phase S (Synthesephase) und verhindert, dass die Brustkrebszellen die S-Phase erreichen, was Zellseneszenz und Zelltod (Apoptose) zur Folge hat.[6] Die Zellproliferation wird somit verringert.
Pharmakokinetik
Die absolute Bioverfügbarkeit nach oraler Gabe von 200 mg liegt bei durchschnittlich 45 %. Die maximale Plasmakonzentrationen tritt nach durchschnittlich 8 Stunden auf (4,1 – 24 Stunden).
Abemaciclib wird größtenteils (im Mittel 96,3 %) an Plasmaproteine gebunden. Die Ausscheidung erfolgt primär über die Faeces (durchschnittlich 81 %, hauptsächlich Metabolite) und zu geringen Teilen über den Urin (durchschnittlich 3 %). Die mittlere Plasmahalbwertszeit beträgt 18,3 Stunden.[6]
Nebenwirkungen
Als häufigste Nebenwirkungen wurden Diarrhoe, Übelkeit, Erbrechen, Verringerung der Anzahl weißer (Leukopenie, Neutropenie) und roter Blutkörperchen (Anämie) sowie der Blutplättchen (Thrombozytopenie), Magenschmerzen, Infektionen, Müdigkeit, Appetitverlust und Kopfschmerzen berichtet.[6][7]
Wechselwirkungen mit anderen Arzneimitteln und mit der Nahrungsaufnahme
Da Abemaciclib hauptsächlich über das Leberenzym Cytochrom P450 3A4 (CYP3A4) verstoffwechselt wird, haben Wirkstoffe, die dieses Enzym hemmen (z. B. Ketoconazol) oder induzieren (wie Rifampicin), eine Auswirkung auf die Plasmakonzentration von Abemaciclib. Wird CYP3A4 gehemmt, steigt die Konzentration et vice versa.[6]
Eine Studie ergab keine klinisch relevanten Unterschiede zwischen der Aufnahme mit und ohne Nahrung.[8]
Chemisch-physikalische Eigenschaften
Abemaciclib ist polymorph, pharmazeutisch verwendet wird die Form III. Es handelt sich um ein weißes bis gelbes nicht hygroskopisches Pulver, das in Wasser praktisch unlöslich und in Ethanol schwer löslich ist. Die Löslichkeit ist pH-Wert-abhängig.[9]
Frühe Nutzenbewertung nach § 35a SGB V
Das IQWiG hat 2018 und 2019 in zwei Dossierbewertungen und zwei Addenda untersucht, ob Wirkstoffkombinationen mit Abemaciclib Frauen mit HR-positivem, HER2-negativem lokal fortgeschrittenem oder metastasiertem Brustkrebs einen Zusatznutzen gegenüber der jeweils vom Gemeinsamen Bundesausschuss (G-BA) festgelegten zweckmäßigen Vergleichstherapie haben.
Dem IQWiG zufolge gibt es für Abemaciclib mit Aromatasehemmer in der endokrinen Ersttherapie nach der Menopause einen Hinweis auf geringeren Nutzen im Vergleich zur zweckmäßigen Vergleichstherapie; für eine endokrine Folgetherapie und/oder Frauen vor oder in der Menopause ist ein Zusatznutzen mangels Studiendaten nicht belegt.[10][11] Der G-BA kam in seinem Beschluss für alle vier Situationen (Erst- bzw. Folgetherapie, vor oder in bzw. nach der Menopause) zu dem Ergebnis „Zusatznutzen nicht belegt“.[12]
Für Abemaciclib mit Fulvestrant gibt es dem IQWiG zufolge in der endokrinen Erst- oder Folgetherapie von Frauen nach der Menopause einen Anhaltspunkt für geringeren Nutzen im Vergleich zur zweckmäßigen Vergleichstherapie; für Frauen vor oder in der Menopause ist ein Zusatznutzen mangels geeigneter Studiendaten nicht belegt.[13][14] Gemäß G-BA-Beschluss ist für alle vier Situationen (Erst- bzw. Folgetherapie, vor oder in bzw. nach der Menopause) ein Zusatznutzen nicht belegt.[15]
Präparatenamen
- Eli Lilly and Company: Verzenios (EU) Verzenio (USA, J)
Literatur
- James M. Martin, Lori J. Goldstein: Profile of abemaciclib and its potential in the treatment of breast cancer; Onco Targets Ther., 2018, 11, S. 5253–5259; doi:10.2147/OTT.S149245, PMID 30214230, PMC 6120573 (freier Volltext).
Weblinks
Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Abemaciclib
Einzelnachweise
- Protein Kinase Inhibitors as Sensitizing Agents for Chemotherapy. Academic Press, 2018, ISBN 978-0-12-812738-4, S. 140 (eingeschränkte Vorschau in der Google-Buchsuche).
- Safety Data Sheet. (PDF) In: achemblock.com. Dezember 2017, abgerufen am 17. März 2019 (englisch).
- FDA approves new treatment for certain advanced or metastatic breast cancers, PM FDA vom 28. September 2017, abgerufen am 4. Dezember 2017
- Abemaciclib: Dritter Cdk4/6-Hemmer in Europa zugelassen. In: Krebsinformationsdienst. Deutsches Krebsforschungszentrum, 8. Oktober 2018, abgerufen am 17. März 2019.
- Eintrag zu Abemaciclib in der DrugBank der University of Alberta, abgerufen am 17. März 2019.
- HIGHLIGHTS OF PRESCRIBING INFORMATION (VERZENIO). (PDF) September 2017, abgerufen am 17. März 2019 (englisch).
- Abemaciclib. In: drugs.com. 8. Oktober 2018, abgerufen am 17. März 2019 (englisch).
- Abemaciclib in Tablettendarreichungsform ist bioäquivalent zu Kapseln. In: medonline.at. 7. Dezember 2017, abgerufen am 17. März 2019.
- Assessment report Verzenios. Ausschuss für Humanarzneimittel der europäischen Arzneimittelagentur, Juli 2018.
- A18-72 Abemaciclib in Kombination mit einem Aromatasehemmer (Mammakarzinom) - Nutzenbewertung gemäß §35a SGB V, abgerufen am 5. Juli 2019.
- A19-24 Abemaciclib (Mammakarzinom; Kombination mit einem Aromatasehemmer) - Addendum zum Auftrag A18-72, abgerufen am 5. Juli 2019.
- Beschluss des Gemeinsamen Bundesausschusses vom 02.05.2019 über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Abemaciclib (Brustkrebs, in Kombination mit einem Aromatasehemmer), abgerufen am 24. Juni 2019.
- A18-73 Abemaciclib in Kombination mit Fulvestrant (Mammakarzinom) - Nutzenbewertung gemäß §35a SGB V, aufgerufen am 5. Juli 2019.
- A19-25 Abemaciclib (Mammakarzinom; Kombination mit Fulvestrant) - Addendum zum Auftrag A18-73, abgerufen am 5. Juli 2019.
- Beschluss des Gemeinsamen Bundesausschusses vom 02.05.2019 über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII – Abemaciclib (Brustkrebs; in Kombination mit Fulvestrant), abgerufen am 5. Juli 2019.