2,7-Di-tert-butylthiepin
2,7-Di-tert-butylthiepin ist eine heterocyclische chemische Verbindung. Sie besteht aus einem Thiepingrundgerüst, an dessen 2- und 7-Positionen tert-Butylreste substituiert sind.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
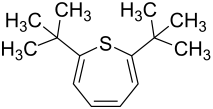 | ||||||||||
| Allgemeines | ||||||||||
| Name | 2,7-Di-tert-butylthiepin | |||||||||
| Summenformel | C14H22S | |||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 222,39 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
1,08 g·cm−3 [1] | |||||||||
| Schmelzpunkt | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Herstellung
2,7-Di-tert-butylthiepin kann durch eine Ringerweiterung aus einem Derivat des 2,6-Di-tert-butylthiopyran gebildet werden. Die eingesetzte Verbindung besitzt eine Abgangsgruppe, wodurch die Ringerweiterung ermöglicht wird. Zu dieser Reaktion werden Essigsäureanhydrid und Natriumacetat verwendet.[1]

Eigenschaften
Es handelt sich um einen farblosen Feststoff, der bei 36 °C schmilzt. Die Verbindung liegt in einer Wannenkonformation, bei der vier Kohlenstoffatome eine Ebene bilden, vor.[3] Sie besitzt ein System aus acht π-Elektronen und gehört zu den antiaromatischen Verbindungen. Die meisten Thiepine sind instabile Verbindungen, die sich unter der Abspaltung von Schwefel zu Benzolderivaten zersetzen. 2,7-Di-tert-butylthiepin ist jedoch deutlich stabiler als Thiepin selbst. Dies liegt in der sterischen Hinderung, die durch die ausladenden tert-Butylreste verursacht wird, begründet. In siedendem Toluol besitzt es eine Halbwertszeit von 365 Stunden.[3]
Reaktionen
2,7-Di-tert-butylthiepin kann durch die Umsetzung mit Triphenylphosphan zur Synthese von 1,2-Di-tert-butylbenzol verwendet werden.[1]
Des Weiteren können Cycloadditionen durchgeführt werden[4], was auf den antiaromatischen Charakter des Thiepinrings zurückzuführen ist.
Einzelnachweise
- K. Yamamoto, S. Yamazaki, Y. Kohashi, I. Murata, Y. Kai, in: Tetrahedron Lett. 1982, 23 (31), 3195–3198.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- R. Gleiter, G. Krennrich, D. Cremer, K. Yamamoto, I. Murata: Electronic Structure and Stability of Thiepins. Photoelectron spectroscopic Investigation, in: J. Am. Chem. Soc. 1985, 107, 6874–6879.
- S. Yamazaki, A. Isokawa, K. Yamamoto, I. Murata, in: J. Chem. Soc., Perkin Trans. 1 1994, 18, 2631–2636.