Yttriumnitrat
Yttriumnitrat ist eine anorganische chemische Verbindung des Yttriums aus der Gruppe der Nitrate.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
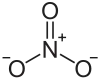 | ||||||||||
| Allgemeines | ||||||||||
| Name | Yttriumnitrat | |||||||||
| Andere Namen |
Yttrium(III)-nitrat | |||||||||
| Summenformel | Y(NO3)3 | |||||||||
| Kurzbeschreibung | ||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 274,92 g·mol−1 | |||||||||
| Aggregatzustand |
fest[2] | |||||||||
| Dichte |
2,68 g·cm−3 (Tetrahydrat)[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
Yttriumnitrat kann durch Reaktion von Yttrium(III)-oxid mit Salpetersäure als Hydrat gewonnen werden.[4]
Die wasserfreie Verbindung ist über thermische Trocknung nicht aus dem Hydrat zu erhalten, da sich dieses dabei in basische Salze zersetzt. Daher wird das wasserfreie Nitrat durch Umsetzung des Oxides mit flüssigem Distickstofftetroxid erhalten[5]:
Eigenschaften
Yttriumnitrat ist als Hexahydrat ein weißlicher geruchloser Feststoff, der löslich in Wasser ist.[2] Bei etwa 100 °C gibt er Teile des Kristallwassers ab.[6] Das Monohydrat besitzt eine trikline Kristallstruktur mit der Raumgruppe P1 (Raumgruppen-Nr. 2).[7]
Verwendung
Yttriumnitrat wird zur Herstellung anderer chemischer Verbindungen, sowie in der Optik, Keramik, Glas und Elektronik eingesetzt. Es wird auch in supraleitenden Materialien verwendet. Es ist ein starker Katalysator für die Synthese einiger Moleküle wie zum Beispiel 1,8-Dioxooctahydroxanthen, 2-Amino-4H-chromen und verschiedener anderer organischer Kondensationsprodukte.[2]
Einzelnachweise
- William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, 2016, ISBN 978-1-4987-5429-3, S. 104 (eingeschränkte Vorschau in der Google-Buchsuche).
- Datenblatt Yttrium(III) nitrate hexahydrate, 99.9% (REO) bei AlfaAesar, abgerufen am 15. April 2018 (PDF) (JavaScript erforderlich).
- Datenblatt Yttrium(III)-nitrat-6-hydrat (PDF) bei Merck, abgerufen am 16. April 2018.
- D. M. A. Melo, M. A .F. Melo, A. E. Martinelli, Z. R. Silva, J. D. Cunha, A. C. Lima: Synthesis and characterization of lanthanum- and yttrium-doped Fe2O3 pigments. In: Ceramica. 53, 2007, S. 79, doi:10.1590/S0366-69132007000100012.
- Therlad Moeller et al.: Anhydrous lanthanon nitrates. In: Therald Moeller (Hrsg.): Inorganic Syntheses. Band 5. McGraw-Hill, Inc., 1957, S. 37–42 (englisch).
- Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2016, ISBN 978-1-4398-1462-8, S. 491 (eingeschränkte Vorschau in der Google-Buchsuche).
- Structure of yttrium nitrate monohydrate, Acta Cryst. (1990). C46, 525–527, doi:10.1107/S0108270189008711.

