Trockenblut
Die Analyse getrockneter Bluttropfen, sogenanntem Trockenblut (englisch Dried blood spot Tests, DBS), auch Blutkärtchen,[1] ist eine Messmethode basierend auf einer Probenahme, bei der Bluttropfen auf Filterpapier getrocknet werden. Die getrockneten Proben können ohne weiteren Aufwand an ein analytisches Labor versandt werden und mit verschiedenen Methoden, wie DNS-Amplifikation oder LC/MS untersucht werden. Die Trockenblutanalyse findet derzeit vor allem Anwendung im Neugeborenenscreening auf Stoffwechselerkrankungen und Endokrinopathien.
Geschichte
Die Methode, kapilläres Blut, welches durch einen Stich in die Ferse oder des Fingers gewonnen wurde, für ein großangelegtes Neugeborenenscreening auf Stoffwechselerkrankungen zu verwenden, wurde von Robert Guthrie 1963 entwickelt (Guthrie-Test). Neugeborenenscreenings auf Phenylketonurie wurde um 1970 eingeführt. Seitdem wurden Guthrie-Karten routinemäßig von Kindern in über 20 Ländern gesammelt, um auf Phenylketonurie und später auf Hypothyreose, Sichelzellanämie und HIV zu testen. Die Einschränkungen bezüglich Sensitivität und Spezifität beim Screening aus dem kleinen Probenvolumen schränkte die Anwendung von Trockenblut-Tests über viele Jahre ein. Mit modernen Methoden, wie der Herstellung monoklonaler Antikörper, synthetischer Proteine und PCR konnten diese Probleme jedoch gelöst werden.[2]
Inzwischen gibt es Bluttests auf Vitamin D, Östrogen, Testosteron, Cortisol, TSH und Fettsäuren. Das Verfahren kommt zudem beim therapeutischen Drug Monitoring[3] und bei toxikologischen Fragestellungen[4] zum Einsatz.
Ablauf der Analyse
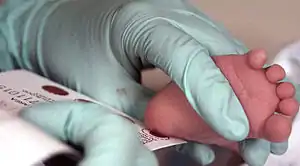
Getrocknete Blutproben werden gewonnen, indem einige wenige Tropfen Blut durch den Stich mit einer Lanzette in Finger, in die Ferse oder die Zehe gewonnen und auf spezielles, saugfähiges Filterpapier aufgetragen werden. Das Blut zieht in das Papier ein und wird für mehrere Stunden luftgetrocknet.[5] Die Proben werden in möglichst luftdichten Plastikbeuteln mit Trockenmittel aufbewahrt, um die Feuchtigkeit zu reduzieren, und können auch in tropischen Klimazonen bei Umgebungstemperatur aufbewahrt und transportiert werden.
Im Labor wird eine kleine Scheibe aus dem gesättigten Papier mit einem automatischen oder manuellen Locher gestanzt. Das ausgestanzte Material wird z. B. in eine Mikrotiterplatte überführt und in phosphatgepufferter Salzlösung, die 0,05 % Tween 80 und 0,005 % Natriumazid enthält, über Nacht bei 4 °C eluiert. Die Platte, die dann die Eluate enthält, bildet den „Master“, aus dem Verdünnungen für die weiteren Tests hergestellt werden.
Als Alternative zum Ausstanzen einer Papierscheibe extrahieren neuere Automatisierungslösungen die Probe, indem sie einen Eluenten durch den Filter spülen, ohne ihn auszustanzen.[6][7][8] Eine Automatisierung einschließlich der Anwendung eines internen Standards vor der Extraktion wurde von der Schweizer Firma CAMAG entwickelt.[9]
Trockenblut-Tests auf HIV-Infektion
Der Methode wird ein hohes Potential bezüglich der Diagnostik für HIV-infizierte Säuglinge in ressourcenarmen Umgebungen zugesprochen, da die Proben lange aufbewahrt werden können, weniger gekühlt werden müssen und die Probenahme weniger invasiv ist als andere Methoden. Im Gegensatz zu ELISA-Tests für HIV-Antikörper im Blut, die unabhängig vom Virus selbst an Säuglinge in der Schwangerschaft übertragen werden können, kann der Trockenblut-Test zum Nachweis genetischen Materials des tatsächlichen Virus verwendet werden, wodurch die Wahrscheinlichkeit eines falsch positiven Ergebnisses reduziert wird. Tests auf HIV werden nicht als ausreichend empfindlich als diagnostisches Verfahren angesehen, können jedoch bei der Einschätzung der HIV-Prävalenz nützlich sein. DBS-Proben stellen für die Anwender zudem ein geringeres Infektionsrisiko dar und sind leichter zu transportieren und zu lagern als flüssige Blutproben.[10]
Grundlagen
Der Grund für die Stabilität von DNS, RNS oder Proteinen liegt vermutlich daran, dass das biologische Material an die Matrix des Filterpapiers bindet und durch den Trocknungsprozess Wasser entfernt wird, das ein wichtiger Faktor für die Wirksamkeit von Proteasen oder Nukleasen ist. Zudem werden Inhibitoren gebunden, die verschiedene Nukleinsäureamplifikationsverfahren stören können.
Einzelnachweise
- T. Arndt: Trockenblut. In: A.M. Gressner, T. Arndt (Hrsg.): Lexikon der Medizinischen Laboratoriumsdiagnostik. Springer Reference Medizin, Berlin / Heidelberg 2019, S. 2363, doi:10.1007/978-3-662-48986-4_3119 (springer.com).
- S. P. Parker, W. D. Cubitt: The use of the dried blood spot sample in epidemiological studies. In: Journal of Clinical Pathology. Band 52, Nr. 9, 1. September 1999, S. 633–639, doi:10.1136/jcp.52.9.633, PMID 10655983.
- Nonnenmacher: Trockenbluttest. In: symptomat.de. 6. Januar 2018, abgerufen am 20. Januar 2018.
- Christophe P. Stove, Ann-Sofie M.E. Ingels, Pieter M.M. De Kesel, Willy E. Lambert: Dried blood spots in toxicology: from the cradle to the grave? In: Critical Reviews in Toxicology. Band 42, Nr. 3, 21. Februar 2012, S. 230–243 (biblio.ugent.be [PDF]).
- Shipping Guidelines for Dried-Blood Spot Specimens. (PDF) In: cdc.gov. Centers for Desease Control and Prevention, 24. Oktober 2017, abgerufen am 20. Januar 2018 (englisch).
- Guido Deußing, Ilka Ottleben: Blutparameter mit Dried-Blood-Spot-Analyse bestimmen. In: Laborpraxis. Vogel Business Media, 4. November 2015, abgerufen am 20. Januar 2018.
- Norbert Ganz, Maharajah Singrasa, Laurent Nicolas, Marcelo Gutierrez, Jasper Dingemanse: Development and validation of a fully automated online human dried blood spot analysis of bosentan and its metabolites using the Sample Card And Prep DBS System. In: Journal of Chromatography B. Band 885–886, 15. Februar 2012, S. 50–60, doi:10.1016/j.jchromb.2011.12.012.
- Using a Book-Type Dried Plasma Spot Card for Automated Flow-Through Elution. In: sparkholland.com. Spark Holland, 20. Dezember 2016, abgerufen am 20. Januar 2018.
- What is Dried Blood Spot Sampling? In: camag.com. Camag, abgerufen am 20. Januar 2018 (englisch).
- S. Cassol, T. Salas, M. J. Gill, M. Montpetit, J. Rudnik: Stability of dried blood spot specimens for detection of human immunodeficiency virus DNA by polymerase chain reaction. In: Journal of Clinical Microbiology. Band 30, Nr. 12, 30. Dezember 1992, ISSN 0095-1137, S. 3039–3042, PMID 1452682.