Titan(III)-oxid
Titan(III)-oxid ist eine anorganische chemische Verbindung des Titans aus der Gruppe der Oxide.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
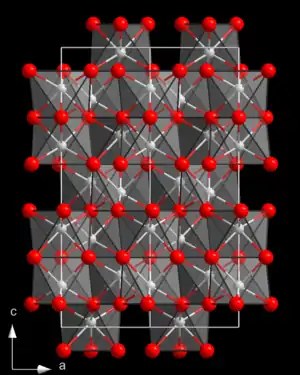 | ||||||||||||||||
| _ Ti3+ _ O2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Titan(III)-oxid | |||||||||||||||
| Andere Namen |
Titansesquioxid | |||||||||||||||
| Verhältnisformel | Ti2O3 | |||||||||||||||
| Kurzbeschreibung |
dunkelvioletter Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 143,73 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
4,49 g·cm−3 (25 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
3000 °C[3] | |||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser, Salzsäure und Salpetersäure[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Vorkommen
Das Mineral Tistarit ist eine sehr seltene und bisher einzige bekannte natürliche Bildung von Titan(III)-oxid.[4]
Gewinnung und Darstellung
Titan(III)-oxid kann durch Reaktion von Titan mit Titan(IV)-oxid bei 1600 °C gewonnen werden.[5]
Es kann auch durch Reaktion von Kohlenmonoxid mit Titan(IV)-oxid bei 800 °C hergestellt werden.[6]
Eigenschaften
Titan(III)-oxid ist ein dunkelviolettes bis schwarzes Pulver, das unlöslich in Wasser ist.[3] Es löst sich in Schwefelsäure unter Violettfärbung der Säure. Bei Erwärmung mit Flusssäure und Königswasser erfolgt eine Zersetzung. Seine Kristallstruktur ist trigonal, isotyp zu der von Korund mit Raumgruppe R3c (Raumgruppen-Nr. 167) (a = 514,8 pm, c = 1363,6 pm).[5] Die Verbindung existiert im Bereich von TiO1,49 bis TiO1,51. Unterhalb von 200 °C ist es ein Halbleiter, darüber metallisch leitend.[7]
Verwendung
Titan(III)-oxid wird als Ausgangsmaterial für Interferenzschichten, Dünnschichtwiderstände und Kondensatoren verwendet.[8]
Einzelnachweise
- Datenblatt Titanium(III) oxide, −100 mesh, 99.9% trace metals basis bei Sigma-Aldrich, abgerufen am 20. Mai 2013 (PDF).
- François Cardarelli: Materials Handbook: A Concise Desktop Reference. Springer, 2008, ISBN 978-1-84628-669-8, S. 619 (eingeschränkte Vorschau in der Google-Buchsuche).
- Roger Blachnik (Hrsg.): Taschenbuch für Chemiker und Physiker. Band III: Elemente, anorganische Verbindungen und Materialien, Minerale. begründet von Jean d’Ans, Ellen Lax. 4., neubearbeitete und revidierte Auflage. Springer, Berlin 1998, ISBN 3-540-60035-3, S. 770 (eingeschränkte Vorschau in der Google-Buchsuche).
- Chi Ma, George R. Rossman: Tistarite, Ti2O3, a new refractory mineral from the Allende meteorite. In: American Mineralogist. Band 94, S. 841–844 (englisch, rruff.info [PDF; 530 kB; abgerufen am 14. Februar 2022]).
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1366.
- Ralf Alsfasser, Erwin Riedel, H. J. Meyer: Moderne Anorganische Chemie. Walter de Gruyter, 2007, ISBN 3-11-019060-5, S. 295 (eingeschränkte Vorschau in der Google-Buchsuche).
- Erwin Riedel, Christoph Janiak: Anorganische Chemie. Walter de Gruyter, 2011, ISBN 3-11-022566-2, S. 793 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. Taylor & Francis US, 2011, ISBN 1-4398-1462-7, S. 479 (eingeschränkte Vorschau in der Google-Buchsuche).