Temperaturgradientengelelektrophorese
Die Temperaturgradientengelelektrophorese (TGGE, englisch temperature gradient gel electrophoresis) und die Denaturierungsgradientengelelektrophorese (DGGE, engl. denaturing gradient gel electrophoresis) sind gelelektrophoretische Verfahren zur Trennung geladener Biomoleküle.[1] Sie verwenden einen Temperaturgradienten oder einen chemischen Gradienten über die Länge des Polyacrylamidgels. Die TGGE und die DGGE werden zur Auftrennung von Nukleinsäuren wie DNA oder RNA und seltener auch für Proteine verwendet. Alternative Verfahren sind z. B. die DNA-Sequenzierung, die SSCP, Heteroduplex-EMSA und denaturierende HPLC.[2]
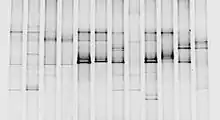
Temperaturgradientengelelektrophorese
Die TGGE ist eine Gelelektrophorese mit einem Temperaturunterschied über die Länge des Gels. Ab einer bestimmten Temperatur schmilzt doppelsträngige DNA in zwei Einzelstränge. Der Schmelzpunkt ist von der DNA-Sequenz und ihrer Basenpaarung abhängig und lässt sich näherungsweise berechnen. Ab der Schmelztemperatur sinkt die Wanderungsgeschwindigkeit der DNA im Gel deutlich. Der Gradient kann parallel zur elektrophoretischen Wanderungsrichtung (englisch parallel TGGE) oder orthogonal (engl. perpendicular TGGE) dazu angelegt werden. Die orthogonal orientierten Gradienten erlauben die Identifikation des Schmelzpunktes und des optimalen Temperaturbereichs für eine möglichst scharfe Trennung. Bei parallel zur Elektrophorese verlaufenden Temperaturgradienten erfolgt eine Auftrennung anhand unterschiedlicher Schmelzpunkte, und nur anfänglich nach der Molmasse. Dadurch können sowohl Mutationen als auch Sekundärstrukturen erkannt werden. Eine Variante der TGGE verwendet zuvor eine Hybridisierung zu Heteroduplexen, um die Unterschiede in der elektrophoretischen Mobilität zu verstärken.[3]
Denaturierungsgradientengelelektrophorese
Bei der DGGE enthält das Gel einen chemischen Gradienten eines Chaotrops.[4] Die Aufhebung von Sekundärstrukturen erfolgt durch die zunehmend denaturierende Konzentration des Chaotrops. Die Denaturierung erfolgt meistens nicht kontinuierlich über den Gradienten, sondern in diskreten Schritten. Dadurch können Mutationen wie SNP in zwei DNA-Sequenzen verglichen werden. Der Nachteil der chemischen Gradienten ist dessen geringe Reproduzierbarkeit und bei Heteroduplexen eine gelegentlich unscharfe Auftrennung.
Geschichte
Die DGGE wurde ab 1979 von Leonard Lerman und Stuart Fischer an der SUNY Albany entwickelt.[5][6][7] Die Trennung von Proteinen per DGGE wurde erstmals 1994 von Thomas E. Creighton am MRC in Cambridge beschrieben.[8] Die TGGE wurde ab 1981 durch Thatcher und Hodson sowie durch Roger Wartell entwickelt.[9][10][11]
Einzelnachweise
- G. Muyzer: DGGE/TGGE a method for identifying genes from natural ecosystems. In: Current Opinion in Microbiology. Band 2, Nummer 3, Juni 1999, ISSN 1369-5274, S. 317–322, doi:10.1016/S1369-5274(99)80055-1, PMID 10383868.
- C. N. Hestekin, A. E. Barron: The potential of electrophoretic mobility shift assays for clinical mutation detection. In: Electrophoresis. Band 27, Nummer 19, Oktober 2006, ISSN 0173-0835, S. 3805–3815, doi:10.1002/elps.200600421, PMID 17031787.
- M. Salimullah, K. Hamano, M. Tachibana, K. Inoue, K. Nishigaki: Efficient SNP analysis enabled by joint application of the muTGGE and heteroduplex methods. In: Cellular & molecular biology letters. Band 10, Nummer 2, 2005, ISSN 1425-8153, S. 237–245, PMID 16010289.
- R. Fodde, M. Losekoot: Mutation detection by denaturing gradient gel electrophoresis (DGGE). In: Human mutation. Band 3, Nummer 2, 1994, ISSN 1059-7794, S. 83–94, doi:10.1002/humu.1380030202, PMID 8199599.
- S. G. Fischer, L. S. Lerman: Length-independent separation of DNA restriction fragments in two-dimensional gel electrophoresis. In: Cell. Band 16, Nummer 1, Januar 1979, ISSN 0092-8674, S. 191–200, PMID 369706.
- S. G. Fischer, L. S. Lerman: Separation of random fragments of DNA according to properties of their sequences. In: Proceedings of the National Academy of Sciences. Band 77, Nummer 8, August 1980, ISSN 0027-8424, S. 4420–4424, PMID 6254023, PMC 349855 (freier Volltext).
- S. G. Fischer, L. S. Lerman: DNA fragments differing by single base-pair substitutions are separated in denaturing gradient gels: correspondence with melting theory. In: Proceedings of the National Academy of Sciences. Band 80, Nummer 6, März 1983, ISSN 0027-8424, S. 1579–1583, PMID 6220406, PMC 393645 (freier Volltext).
- T. E. Creighton, D. Shortle: Electrophoretic characterization of the denatured states of staphylococcal nuclease. In: Journal of molecular biology. Band 242, Nummer 5, Oktober 1994, ISSN 0022-2836, S. 670–682, doi:10.1006/jmbi.1994.1616, PMID 7932723.
- D. R. Thatcher, B. Hodson: Denaturation of proteins and nucleic acids by thermal-gradient electrophoresis. In: The Biochemical journal. Band 197, Nummer 1, Juli 1981, ISSN 0264-6021, S. 105–109, PMID 6797412, PMC 1163059 (freier Volltext).
- R. M. Wartell, S. H. Hosseini, C. P. Moran: Detecting base pair substitutions in DNA fragments by temperature-gradient gel electrophoresis. In: Nucleic acids research. Band 18, Nummer 9, Mai 1990, ISSN 0305-1048, S. 2699–2705, PMID 2339057, PMC 330754 (freier Volltext).
- J. Zhu, R. M. Wartell: The relative stabilities of base pair stacking interactions and single mismatches in long RNA measured by temperature gradient gel electrophoresis. In: Biochemistry. Band 36, Nummer 49, Dezember 1997, ISSN 0006-2960, S. 15326–15335, doi:10.1021/bi9716783, PMID 9398261.