Spaltbares Tensid
Ein spaltbares Tensid ist ein Tensid, das unter vergleichsweise milden Bedingungen hydrolysiert werden kann. Spaltbare Tenside werden in der Proteinreinigung in Vorbereitung einer Massenspektrometrie verwendet.[1][2]
Eigenschaften
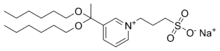
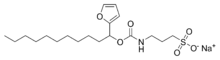
Reste von Tensiden wie Natriumlaurylsulfat (SDS) oder Octyl-Glucosid können die Auswertung von massenspektrometrischen Daten erschweren.[1] Die Entfernung der Tenside von den zu untersuchenden Peptiden z. B. nach einem In-Gel-Verdau ist oftmals unvollständig. Bei der Elektrospray-Ionisation stören Tenside mehr als beim MALDI-TOF.[3] Dagegen sind Membranproteine und Lipide nur in Anwesenheit von Tensiden wasserlöslich. Daher wurden spaltbare Tenside entwickelt, die unter schwach sauren Bedingungen hydrolysieren, während die Peptide davon unberührt bleiben, z. B. 3-[3-(1,1-Bisalkyloxyethyl)pyridin-1-yl]propan-1-sulfonat (PPS),[4] PPS mit Methanol,[5] 3-{[1-(Furan-2-yl)undecyloxy]carbonylamino}propan-1-sulfonat (Protease MAX), 3-[(2-methyl-2-undecyl-1,3-dioxolan-4-yl)methoxy]-1-propansulfonat (RapiGest SF).
Alternativen
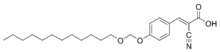
Spaltbare amphiphile Derivate von α-Cyano-4-hydroxyzimtsäure (CHCA), die über Formaldehyd an Decanol gekoppelt wurden, müssen nicht entfernt werden, da sie gleichzeitig als Matrix in der MALDI-TOF-MS verwendet werden können. Ebenso kann eine Matrix aus α-Cyano-4-hydroxyzimtsäure mit Cetyltrimethylammoniumbromid bei der MALDI-TOF-MS verwendet werden.[6] Es gibt Matrix-Mischungen, die weniger empfindlich gegenüber Tensiden sind.[3]
Einzelnachweise
- J. L. Norris, N. A. Porter, R. M. Caprioli: Mass spectrometry of intracellular and membrane proteins using cleavable detergents. In: Analytical chemistry. Band 75, Nummer 23, Dezember 2003, S. 6642–6647, doi:10.1021/ac034802z. PMID 14640740.
- J. L. Norris, N. A. Porter, R. M. Caprioli: Combination detergent/MALDI matrix: functional cleavable detergents for mass spectrometry. In: Analytical chemistry. Band 77, Nummer 15, August 2005, S. 5036–5040, doi:10.1021/ac050460g. PMID 16053319.
- L. Signor, E. Boeri Erba: Matrix-assisted laser desorption/ionization time of flight (MALDI-TOF) mass spectrometric analysis of intact proteins larger than 100 kDa. In: Journal of visualized experiments : JoVE. Nummer 79, 2013, S. , doi:10.3791/50635. PMID 24056304. PMC 3857990 (freier Volltext).
- X. Ye, D. J. Johann, R. M. Hakami, Z. Xiao, Z. Meng, R. G. Ulrich, H. J. Issaq, T. D. Veenstra, J. Blonder: Optimization of protein solubilization for the analysis of the CD14 human monocyte membrane proteome using LC-MS/MS. In: Journal of proteomics. Band 73, Nummer 1, November 2009, S. 112–122, doi:10.1016/j.jprot.2009.08.008. PMID 19709643. PMC 3159575 (freier Volltext).
- T. Nabetani, A. Makino, F. Hullin-Matsuda, T. A. Hirakawa, S. Takeoka, N. Okino, M. Ito, T. Kobayashi, Y. Hirabayashi: Multiplex analysis of sphingolipids using amine-reactive tags (iTRAQ). In: Journal of lipid research. Band 52, Nummer 6, Juni 2011, S. 1294–1302, doi:10.1194/jlr.D014621. PMID 21487068. PMC 3090250 (freier Volltext).
- R. Gottardo, A. Chiarini, I. Dal Prà, C. Seri, C. Rimondo, G. Serpelloni, U. Armato, F. Tagliaro: Direct screening of herbal blends for new synthetic cannabinoids by MALDI-TOF MS. In: Journal of Mass Spectrometry Band 47, Nummer 1, Januar 2012, S. 141–146, doi:10.1002/jms.2036. PMID 22282100.