Säurepufferkapazität
Die Säurepufferkapazität oder Säureneutralisationskapazität ist ein Maß für die gesamte Pufferkapazität gegen die Ansäuerung einer Lösung (wie Oberflächenwasser oder Bodenwasser).
Sie wird definiert als die Differenz zwischen den Kationen starker Basen und den Anionen starker Säuren (siehe unten) oder dynamisch als die Menge an Säure, die benötigt wird, um den pH-Wert der Probe auf einen anderen gewählten Wert zu ändern.[1] Das Konzept der Alkalinität wird heute häufig als Synonym zur positiven Säurepufferkapazität verwendet und Acidität als negative Säurepufferkapazität gedeutet. Alkalinität und Acidität haben jedoch eigene Definitionen, die auf einem experimentellen Aufbau (Titration) basieren.
Die Säurepufferkapazität wird häufig in Modellen genutzt, um den Versauerungsgrad durch sauren Regen in verschiedenen geografischen Gebieten zu berechnen, sowie als Grundlage für die Berechnung der kritischen Belastungen für Waldböden und Oberflächenwasser. Sobald für einen See die Beziehung von pH-Wert und Säurepufferkapazität erstellt wurde, kann diese verwendet werden, um die Menge an Kalkstein zu berechnen, die benötigt wird, um den pH-Wert auf einen bestimmten Wert einzustellen. Allerdings sind nicht alle sauren Seen aufgrund von menschlichen Einflüssen sauer, da auch ein hoher Anteil an gelöstem organischen Kohlenstoff (DOC) einen niedrigen pH-Wert bewirkt.
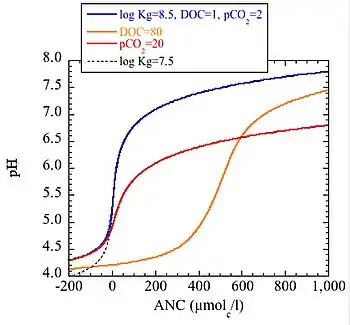
Das Verhältnis zwischen pH-Wert und Säurepufferkapazität in natürlichen Gewässern hängt von drei Bedingungen ab: Kohlenstoffdioxid, Organische Säuren und Löslichkeit von Aluminium. Bei der Zersetzung von organischem Material wird Kohlenstoffdioxid freigesetzt, wodurch sich die Menge an gelöstem Kohlenstoffdioxid erhöht. Ein Anstieg des Kohlenstoffdioxids senkt zwar den pH-Wert, hat jedoch keinen Einfluss auf die Säurepufferkapazität. Organische Säuren, häufig ausgedrückt als gelöster organischer Kohlenstoff, senken ebenfalls den pH-Wert und haben keinen Einfluss auf die Säurepufferkapazität. Bodenwasser aus den oberen Bodenschichten hat normalerweise einen höheren Anteil an gelöstem organischen Kohlenstoff als das aus den unteren Bodenschichten. Oberflächenwasser mit hohem Anteil an gelöstem organischen Kohlenstoff findet sich in Gebieten, in deren Einzugsbereichen sich viele Moore und Torf befinden. Die Aluminiumlöslichkeit ist schwieriger zu beurteilen und es gibt mehrere Varianten zur Kurvenanpassung, die bei der Modellierung verwendet werden. Gebräuchlich ist folgende:
In der Abbildung wird der Zusammenhang von pH-Wert und Säurepufferkapazität für vier verschiedene Lösungen dargestellt. Der blaue Graph stellt eine Lösung mit 1 mg DOC/l dar. Die anderen drei Graphen unterscheiden sich nur hinsichtlich eines Parameters von dem blauen Graphen. Der orange Graph stellt eine Lösung mit organischen Säuren dar, die 80 mg DOC/l enthält (typischerweise sehr braunes Seewasser oder Wasser aus der obersten Schicht des Waldbodens). Der rote Graph stellt eine hohe Menge an gelöstem Kohlenstoffdioxid dar, die im Grundwasser nicht ungewöhnlich ist. Schließlich stellt der schwarze Graph ein Wasser mit geringer Aluminiumlöslichkeit dar. Es ist zu erkennen, dass eine Änderung des Anteils an DOC oder CO2 (oder der Aluminiumlöslichkeit, die jedoch nur schwer zu kontrollieren ist) keine Auswirkungen auf die Säurepufferkapazität hat.
Der Grund, weshalb die Säurepufferkapazität häufig als Differenz von Kationen starker Basen und Anionen starker Säuren definiert wird, liegt darin, dass die Säurepufferkapazität aus der Ladungsbilanz abgeleitet wird: Bei einer Lösung mit nur wenigen verschiedenen Ionen und unter Berücksichtigung, dass eine wässrige Lösung elektrisch neutral ist, ergibt sich folgendes Beispiel:
Dabei bezeichnet R− ein Anion einer organischen Säure. Die Säurepufferkapazität wird dann definiert, indem alle vom Gleichgewicht kontrollierten Ionenarten (d. h. Arten, die schwachen Säuren und schwachen Basen zuzuordnen sind) auf einer Seite gesammelt werden und auf der anderen Seite alle Ionenarten, die nicht vom Gleichgewicht kontrolliert werden (d. h. Arten, die starken Säuren und starken Basen zuzuordnen sind). Für unser Beispiel von oben erhalten wir:
Oder: