Rubidiumazid
Rubidiumazid ist eine chemische Verbindung aus Rubidium und Stickstoff.
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
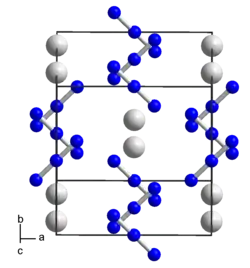 | |||||||
| _ Rb+ _ N1/3− | |||||||
| Kristallsystem |
tetragonal | ||||||
| Raumgruppe |
I4/mcm (Nr. 140) | ||||||
| Gitterparameter |
a = 630,8 pm, c = 753,7 pm, Z = 4 | ||||||
| Allgemeines | |||||||
| Name | Rubidiumazid | ||||||
| Verhältnisformel | RbN3 | ||||||
| Kurzbeschreibung |
farblose, leicht hygroskopische Kristalle[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 127,488 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Dichte |
2,79 g·cm−3[2] | ||||||
| Schmelzpunkt | |||||||
| Löslichkeit | |||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Herstellung
Rubidiumazid kann aus Rubidiumcarbonat und Natriumazid hergestellt werden.[4]
Rubidiumazid entsteht auch bei der Einwirkung von Stickstoff auf Rubidium unter dem Einfluss einer elektrischen Entladung. Parallel dazu entsteht Rubidiumnitrid.[5]
Eigenschaften
Physikalische Eigenschaften
Rubidiumazid kristallisiert im tetragonalen Kristallsystem in der Raumgruppe I4/mcm (Raumgruppen-Nr. 140) mit den Gitterparametern a = 630,8 pm, c = 753,7 pm, und 4 Formeleinheiten pro Elementarzelle.[1][6]
Einzelnachweise
- Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-5406-0035-0, S. 688 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dale L. Perry, Sidney L. Phillips: Handbook of inorganic compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 333 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Dissertation: "Strukturchemische Untersuchungen von Halogenidaziden des Bariums, Thalliums und Zinks", Universität Dortmund, 2001. PDF
- H. Wattenberg: Über zwei Bildungsweisen von Natriumnitrid und Kaliumnitrid in Ber. d. dt. chem. Ges. 1930, 63(7), S. 1667–1672. doi:10.1002/cber.19300630708.
- Ulrich Müller: "Verfeinerung der Kristallstrukturen von KN3, RbN3, CsN3 und TlN3" in Zeitschr. f. anorg. u. allg. Chem. 1972, 392(2), S. 159–166. doi:10.1002/zaac.19723920207
- Don M. Yost: "Systematic Inorganic Chemistry", Verlag Read Books, 2007. ISBN 978-1-4067-7302-6. S. 128ff. (eingeschränkte Vorschau in der Google-Buchsuche)
- R. Abegg, F. Auerbach: 'Handbuch der anorganischen Chemie'. Verlag S. Hirzel, Bd. 2, 1908. S. 430.Volltext
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.