Rote Seescheide
Die Rote Seescheide oder auch Rote Kännchenseescheide[1] (Halocynthia papillosa) ist eine im Mittelmeer vorkommende Ascidie (Seescheide) und gehört zu den Tunicata (Manteltiere). H. papillosa wurde im Jahre 1767 erstmals von dem schwedischen Naturforscher Carl von Linné beschrieben.
| Rote Seescheide | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Rote Seescheide (Halocynthia papillosa) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Halocynthia papillosa | ||||||||||||
| Linnæus, 1767 |
Systematik
Die Rote Seescheide H. papillosa gehört zur Familie der Pyuridae und somit zu der Gruppe der Stolidobranchia[2]. Die Stolidobranchia werden zu den Ascidien gezählt und diese wiederum zum Taxon der Tunicata (Manteltiere). Die Tunicaten werden zu den Chordaten gerechnet, genauer zu den Urochordaten. Somit gehört H. papillosa zu den Deuterostomiern (Neumünder)[3].
Ascidien gehören mit etwa 2000 bekannten Arten zu der formenreichsten Klasse der Tunicata[4].
Artbestimmung
H. papillosa besitzt auf jeder Seite eine ungeteilte Zwitterdrüse, die vorhandenen Dorsalzungen sind getrennt und die zwei- bis vierlappigen Siphone deutlich abgesetzt. Diese werden wiederum von bräunlichen Borsten umrandet. Diese Merkmale, zusammen mit dem orange- bis korallenroten papillösem Mantel, machen H. papillosa zu einer leicht zu erkennenden Ascidien-Art[5].
Vorkommen
Halocynthia papillosa kommt im gesamten Mittelmeerraum vor und ist somit die häufigste im Benthos vorkommende Ascidien-Art, die auf steinigem und felsigem Untergrund des Litorals zu finden ist[6][7][1]. Auf sandigem Untergrund im Sublitoral und auch in Posidonia-Seegraswiesen ist sie ebenfalls häufig anzutreffen[5][8]. So ist sie unter anderem an der spanischen und französischen Küste[9] zu finden, sowie auch in der Adria[10]. H. papillosa ist endemisch[7] und lebt als solitäre Ascidie bevorzugt in Küstennähe und in flacheren Zonen[1]. In den Tiefen von 20 – 50 m erreicht sie die größte Abundanz und Individuengröße. Dies liegt daran, dass in diesen Tiefen ein einheitlicher Meeresstrom vorherrscht und somit die Nahrungsaufnahme für Filtrierer einfacher ist, womit ein besseres Wachstum einhergeht. Das bisher tiefste bekannte Vorkommen einer H. papillosa liegt bei 58 m. An Spalten oder felsigen Überhängen ist sie besonders oft vorzufinden[2]. Da H. papillosa eine sehr stress-sensitive Art ist, ist sie eher in Gebieten anzutreffen, die von Menschen weniger stark frequentiert werden[7].
Morphologie
Der Körper besitzt eine sack- bis knollenförmige Struktur, welcher im Inneren durch einen Kiemendarm ausgekleidet ist. Einzelne Individuen können dabei eine Größe von bis zu 15 cm erreichen. Die aus dem Umgebungswasser herausfiltrierten Nahrungspartikel werden über Schleimbänder in den Kiemendarm transportiert[4], welcher den größten Teil des Inneren ausmacht[1]. Genauer erfolgt die Nahrungsaufnahme dadurch, dass durch die Ingestionsöffnung Wasser in die Seescheide eintritt und durch Cilien das Wasser mit den Nahrungspartikeln weiter in das Innere bewegt werden. Die Nahrungspartikel bleiben am schleimabsondernden Endostyl, welches sich ventral am Kiemendarm befindet, hängen und werden für die Verdauung zum Kiemendarm transportiert. Über die Egestionsöffnung tritt das Wasser wieder aus der Ascidie aus. Der Wasserdurchstrom erfolgt hierbei unidirektional[1]. H. papillosa besitzt wie alle Manteltiere ein blind endendes Blutgefäßsystem. Um den gesamten Körper mit ausreichend Sauerstoff versorgen zu können, wird die Pumprichtung des Herzens in regelmäßigen Abständen umgekehrt[4].
Der Mantel von H. papillosa, die Tunica, welcher namensgebend für die Tunicata ist, dient als mechanischer Schutz, welcher epidermalen Ursprungs ist. Das Besondere hierbei ist, dass die Tunica der Ascidien neben Proteinen auch Cellulose enthält. Cellulose kommt normalerweise nur in pflanzlichen Zellen vor und dient dort der Stabilisation der Zellwand. Somit sind Seescheiden die einzigen Tiere, die diesen Pflanzenstoff besitzen[1]. Die Tunica ist das auffälligste an H. papillosa, da diese durch die eingelagerten α- und β-Carotinoide leuchtend rot gefärbt ist, daher kommt auch der deutsche Name „Rote Seescheide“ zustande. Neben den Carotinoiden befinden sich auch noch Cynthiaxanthin und Astaxanthin im Mantel[11].

Die Muskulatur von H. papillosa ist stark reduziert und kommt nur noch im Schwimmschwanz der Larve und in der Ein- und Ausströmöffnung des Adulttieres vor. Das Nervensystem ist mit nur einem Ganglion rudimentär ausgebildet, dieses eine Ganglion ist jedoch zur vollständigen Regeneration fähig. Als Sinnesorgane besitzt H. papillosa ciliäre Sinneszellen, Statocysten und in der Larvenform Pigmentbecherocellen. Ein Exkretionsorgan ist nicht nötig, da die bei der Verdauung anfallenden Abfallprodukte, wie Ammoniumionen über den Kiemendarm direkt in die Umgebung abgegeben werden[1].
Wachstum
Das hauptsächliche Wachstum von H. papillosa findet im Sommer statt, was im Vergleich zu anderen Ascidien-Arten äußerst ungewöhnlich ist, da deren Wachstumsphase in den Wintermonaten liegt. In den Wintermonaten gibt es mehr verfügbare Nahrung, im Sommer ist das Wasser eher oligotroph und beinhaltet somit weniger Nährstoffe, die den Organismen zur Verfügung stehen[6]. Bei H. papillosa findet im Gegensatz zu anderen Arten keine Ästivation statt, im Gegenteil, im Sommer besitzt H. papillosa die höchste Wachstumsrate[7].
Fortpflanzung
Halocynthia papillosa ist ein hermaphroditer Organismus, daher befinden sich sowohl weibliche als auch männliche Geschlechtszellen in einem Individuum. Um eine Selbstbefruchtung zu vermeiden reifen zunächst die Ovarien und im Anschluss die Testis. Ein Individuum reproduziert sich nur einmal im Jahr, das Ovarienwachstum findet von März bis September und das Wachstum der Testis von Juli bis September statt. Die höchste Reproduktionsrate liegt daher am Sommerende. Die Gameten werden dabei direkt in das umgebende Meerwasser abgegeben[6][1]. Kommt es zu einer Befruchtung entwickelt sich eine pelagische Larve, die zwischen 12 und 24 Stunden umherschwimmt, bis sie sich an einer geeigneten Stelle niederlässt und eine Metamorphose durchläuft[12]. Während der Metamorphose vom pelagischen Tier zum sessilen aktiven Filtrierer werden die Chorda, der Schwanz und die Sinnesorgane abgebaut. Der Kiemendarm und Peribranchialraum hingegen werden ausgebaut[1]. Als regulierender Hauptfaktor der Reproduktion kann die Wassertemperatur angesehen werden[6].
Ernährung
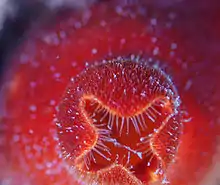
Als mikrophager aktiver Suspensionsfresser ernährt sich H. papillosa von Kleinstlebewesen in der Größe von 0,6 – 70 μm. Darunter sind heterotrophe Bakterien, Phytoplankton, Ciliaten und Prokaryoten. H. papillosa zeichnet sich durch eine sehr heterogene Ernährung aus, welche mitunter dadurch bedingt ist, dass sie kein selektiver Filtrierer ist. Die Nahrungsaufnahme erfolgt dadurch, dass Wasser durch die Filterstrukturen gepumpt wird und die Nahrungspartikel mit Hilfe der Schleimbänder vom Wasser getrennt werden. Die Filtrationsrate hängt hauptsächlich von der Wassertemperatur, der Futterkonzentration, der Individuengröße und dem Sauerstoffgehalt im Wasser ab. Eine optimale Filtration findet bei 23 °C statt[6][2]. Ascidien sind in der Lage, 24 Stunden durchgehend zu filtrieren[9].
Ökosystemdienstleistung
H. papillosa ist eine wichtige Kohlenstoff-sink (Senke), da sie durch die aktive Filtration einen wichtigen Beitrag zur Regulation des Phytoplanktons beiträgt und somit einer Eutrophierung des Wassers entgegenwirkt. Durch die Häufigkeit und weite Verbreitung dieser Art stellt sie einen Schlüssel-Organismus dar, da der größte Teil der Phytoplankton-Regulation von H. papillosa geleistet wird[2].
Bioindikator
Der zunehmende Tauchtourismus stellt eine Beeinträchtigung für die im Litoral lebenden Organismen dar, da Taucher durch das Berühren der Organismen mit ihrem Körper oder der Tauchausrüstung erheblichen Schaden verursachen können. Das von Tauchern aufgewirbelte Bodensubstrat stellt ein ebenso großes Problem dar, besonders für filtrierende Organismen wie H. papillosa. Das aufgewirbelte Sediment kann den Mantel beschädigen oder in den Siphon von Ascidien geraten und somit die Nahrungsaufnahme beeinträchtigen, was ein schlechteres Wachstum und eine niedrigere Fortpflanzungsrate zur Folge hätte. Die Ansiedlung der pelagischen Larve in einem neuen Gebiet wird durch aufgewirbeltes Sediment ebenfalls stark eingeschränkt. Als äußerst stress-sensitive Art eignet sich H. papillosa als Bioindikator, da die Individuenzahl in stark frequentierten Bereichen deutlich zurückgeht. Somit ist der Zustand der korallogenen Gemeinschaft an der Individuenzahl und -größe von H. papillosa ablesbar. Dadurch kann ein zu stark von Tauchern besuchtes Gebiet rechtzeitig geschützt werden, bevor der Schaden unumkehrbar ist. Die Attraktivität des Tauchplatzes nimmt im Zuge einer zu hohen Frequentierung ab, da H. papillosa, durch die hohe Frequentierung bedingt, mehr an versteckten und geschützteren Stellen wachsen und nicht sofort für die Taucher zu erkennen sind[7][13]. Allgemein zeigt eine hohe Abundanz von großen H. papillosa, dass das Gebiet in einem guten Zustand ist, da für das Gedeihen von H. papillosa sauberes Wasser, neben der stressfreien Umgebung, ebenfalls wichtig ist[14]. Ein Beispiel hierfür ist die Küste Spaniens: in Küstennähe von Montgrí befinden sich mehr und größere H. papillosa als in der Nähe der ca. zwei Kilometer entfernten Insel Medas, da diese bei Tauchern sehr beliebt ist und daher häufiger besucht wird[2].
Haltung
Durch die auffällige Färbung von H. papillosa ist sie ein beliebtes und auch ausdauerndes Aquarientier in zoologischen Gärten.[5] Neben dem Tierpark Berlin kann die Rote Seescheide ebenfalls im zoologisch-botanischen Garten Wilhelma in Stuttgart bewundert werden.[1][15]
Literatur
- Ibler, B. (2012). Artenliste und Haltung von Seescheiden (Ascidiacea) in Berlin. Der Zoologische Garten 81(4): 175–184.
- M. Coppari, A. Gori und S. Rossi: Size, spatial and bathymetrical distribution of the ascidian Halocynthia papillosa in Mediterranean coastal bottoms: benthic-pelagic coupling implications. In: Marine Biology. Band 161, Nr. 9, 2014, S. 2079–2095.
- G. Lecointre, H. Le Guyader: Biosystematik: alle Organismen im Überblick; die neue Ordnung im Leben. Springer, Heidelberg [u. a.] 2006.
- F. Bracher: Seescheiden (Ascidien) - einen neue Quelle pharmakologisch aktiver Substanzen. In: Pharmazie in unserer Zeit: Wissenschaft, Bildung und Weiterbildung. Band 23, S. 147–157.
- R. Riedl: Fauna und Flora des Mittelmeeres: ein systematischer Meeresführer für Biologen und Naturfreunde. Hrsg.: Parey. 3. Auflage. Hamburg [u. a.] 1983.
- M. Ribes, R. Coma und J. M. Gili: Seasonal variation of in situ feeding rates by the temperate ascidian Halocynthia papillosa. In: Marine Ecology Progress. Band 175, 1998, S. 201–213.
- B. Luna-Perez, C. Valle, T. Vega Fernandez et al.: Halocynthia papillosa (Linnaeus, 1767) as an indicator of SCUBA diving impact. In: Ecological Indicators. Band 10, Nr. 5, 2010, S. 1017–1024.
- V. Neumann, T. Paulus und H. A. Baensch: Mittelmeer-Atlas: Fische und ihre Lebensräume. Mergus, Melle 2005.
- A. Fiala-Médioni: Ethologie alimentaire d'invertébrés benthiques filtreurs (ascidies). II. Variationsdes taux de filtration et de digestion en fonction de l'espèce. In: Marine Biology. Band 28, Nr. 3, S. 199–206.
- M. Santic, B. Rada, A. Paladin et al.: The Influence of Some Abiotic Parameters on Growth Inclination in Ascidian Halocynthia papillosa (Linnaeus, 1767) from the Northern Adriatic Sea (Croatia). In: Archives of Biological Sciences. Band 62, Nr. 4, S. 1007–1011.
- K. Nishibori: Studies on the pigments of marine animals - VI. Carotenoids of some tunicates. 1958.
- B. Lübbering, T. Nishikata und G. Goffinet: Initial stages of tuic morphogenesis in the ascidian Halocynthia: A fine structural study. In: Tissue and Cell. Band 24, Nr. 1, 1992, S. 121–130.
- B. Luna-Perez, C. Valle-Perez und J. L. Sanchez-Lizaso: Halocynthia papillosa as SCUBA diving impact indicator: An in situ experiment. In: Journal of Experimental Marine Biology and Ecology. Band 398, Nr. 1-2, 2011, S. 33–39.
- S. Naranjo, J. Carballo und J. Garcia-Gomez: Effects of environmental stress on ascidian populations in Algeciras Bay (southern Spain). Possible marine bioindicators. In: Marine Ecology Progress Series. Band 144, 1996, S. 119–131.
- Tierbestand 2017 Zoologisch-botanischer Garten Stuttgart. (PDF) In: wilhelma.de. Abgerufen am 27. Januar 2019.
Weblinks
- World Register of Marine Species, Monniot, C. (2009):Halocynthia papillosa (Linnaeus, 1767)