Riesenzellarteriitis
Die Riesenzellarteriitis (RZA) (früher Arteriitis cranialis, Arteriitis temporalis, Morbus Horton, Horton-Magath-Brown-Syndrom) ist eine systemische Gefäßentzündung (Vaskulitis), die vor allem bei älteren Menschen die Schläfenarterien (Arteriae temporales) befällt. Unbehandelt besteht ein Risiko von 20 Prozent zu erblinden, da die Entzündung der Arterien zu einer ungenügenden Durchblutung der Sehnervenpapille führt. Bei entsprechender Diagnostik und einem raschen Therapiebeginn mit Cortisonpräparaten ist der Erkrankungsverlauf meist gutartig, wenn auch langwierig.
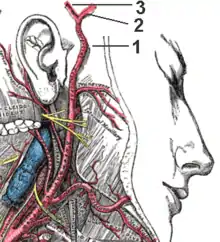
2 Frontaler Ast
3 Parietaler Ast
| Klassifikation nach ICD-10 | |
|---|---|
| M31.5 | Riesenzellarteriitis bei Polymyalgia rheumatica |
| M31.6 | Sonstige Riesenzellarteriitis |
| ICD-10 online (WHO-Version 2019) | |
Die Riesenzellarteriitis wird zusammen mit der Takayasu-Arteriitis zur Gruppe der Großgefäßvaskulitiden gezählt.
Häufigkeit
Die RZA betrifft zu über 75 % ältere Frauen. Die Inzidenz (Neuerkrankungen pro Jahr) beträgt bei Menschen unter 60 Jahre weniger als 5:100.000. Bis zum 70. Lebensjahr steigt sie auf über 10, im 8. Lebensjahrzehnt auf 40 und danach auf 50:100.000.[1] Frauen sind im Verhältnis 2- bis 6-mal häufiger betroffen als Männer.[2]
Pathogenese
Die RZA ist eine T-Zell-abhängige Autoimmunerkrankung mit genetischer Prädisposition. Infekte können einen Krankheitsausbruch triggern, diskutiert werden insbesondere Viren (beispielsweise HBV, Influenzaviren und VZV) und Bakterien wie Borrelien und Klebsiella.[3]
Es entsteht meist eine granulomatöse Vaskulitis, die vorwiegend die großen und mittelgroßen Arterien befällt. Bei dem am häufigsten vorkommenden kranialen Befallsmuster ist die Arteria temporalis superficialis, oft simultan mit den übrigen oberflächlichen Schädelarterien (z. B. A. occipitalis) betroffen.[4] Der Befall der Arteria ophthalmica in 30 % der Fälle ist gefürchtet und kann zur Erblindung führen. Auch ein Befall der A. temporalis profunda mit entzündlicher Begleitreaktion M. temporalis kann vorkommen und verursacht möglicherweise die von Patienten oft beklagten Kauschmerzen.[5] Beim extra-kranialen Befallsmuster sind primär die Aorta und die aortalen Äste betroffen.[6] Intrakranielle Gefäße, Herzkranzgefäße und andere Organe sind selten (bei weniger als einem Prozent) befallen. Es besteht eine Beziehung zur Polymyalgia rheumatica, beide Krankheiten können aber durchaus unabhängig voneinander auftreten.
Durch die Entzündung, die auch segmental auftreten kann, kommt es zu einem Ödem innerhalb der Gefäßwand. Die ödematöse Verdickung der Gefäßwand führt zur Einengung des Gefäßlumens, was eine Minderdurchblutung der von der betroffenen Arterie versorgten Gebiete nach sich ziehen kann. Ist die Arteria centralis retinae betroffen, kann dies innerhalb einer Stunde zu irreversiblen Schäden an der Netzhaut führen.
Symptome
Mehr als 70 Prozent der Patienten berichten als Erstsymptom über einen starken, bohrend-stechenden Kopfschmerz, der häufig durch Kauen noch verstärkt wird (Claudicatio masticatoria). Typisch ist auch eine einseitige, plötzlich einsetzende hochgradige Sehminderung bis zur Erblindung, die bei etwa 30 % der Erkrankten auftritt und einen sofortigen Therapiebeginn erforderlich macht. Daneben werden beidseitig an den Schläfen verdickte, harte, vermehrt geschlängelte, pulslose und druckempfindliche Temporalarterien gefunden. In 12–15 % der Fälle treten das Herabhängen eines Augenlides (Ptosis) oder andere Augenmuskellähmungen sowie häufig Allgemeinsymptome wie Fieber, Gewichtsabnahme, Abgeschlagenheit, Müdigkeit und Muskelschmerzen auf. Bei einem Teil der Patienten mit RZA treten diese kopfbetonten Symptome jedoch nicht auf, weshalb man dazu übergangen ist, zwischen einem klassischen kranialen Befallsmuster und einem extra-kranialen Befallsmuster zu unterscheiden. Bei Patienten mit extra-kranialem Befallsmuster sind die Symptome wesentlich unspezifischer. Sie umfassen z. B. Müdigkeit, Abgeschlagenheit, Fieber, eine unspezische systemische Entzündungsreaktion ohne klaren Fokus. Bei der Diagnostik lässt sich dann in der Regel eine Aortitis, d. h. eine Entzündung der Hauptschlagader, feststellen. Während bei älteren Patienten (> 80 Jahre) das klassische kraniale Befallsmuster häufiger auftritt, findet sich bei Patienten unter 70 Jahren ein größerer Anteil mit extra-kranialem Befall.[7]
Diagnostik
| Kriterium | Sensitivität | Spezifität |
|---|---|---|
| Erkrankungsalter > 50 Jahre | 98,6 % | 63,9 % |
| Neuartige oder neu auftretende umschriebene Kopfschmerzen |
64,5 % | 81,9 % |
| Abnorme Temporalarterie (Druckschmerz, abgeschwächte Pulsation) |
57,3 % | 96,8 % |
| BSG > 50 mm in der ersten Stunde | 86,5 % | 47,7 % |
| Histologische Veränderungen bei der Biopsie der Temporalarterie |
92,9 % | 73,1 % |
Diagnostische ACR-Kriterien
Das American College of Rheumatology (ACR) hat 1990 Kriterien für die Diagnose einer RZA veröffentlicht, die als „diagnostische ACR-Kriterien“ Eingang in verschiedene Leitlinien (beispielsweise der Deutschen Gesellschaft für Neurologie von 2003) gefunden haben. Tabelle 1 zeigt diese Kriterien und deren Sensitivität und Spezifität anhand eines Vergleichs von 214 Patienten mit Arteriitis cranialis mit 593 Personen mit anderen Vaskulitiden. Wenn drei der fünf Kriterien erfüllt sind, kann die Diagnose einer RZA mit einer Sensitivität von 75 % und einer Spezifität von 92 % gestellt werden. Die ACR-Kriterien sind auf das klassische kraniale Befallsmuster der RZA ausgerichtet und haben nur eine limitierte Sensitivität für die Diagnostik einer RZA mit extra-kranialem Befallsmuster.[7]
Sonografie
Die sonografische Untersuchung der Temporalarterie und ihrer Seitenäste zeigt bei der RZA typischerweise eine echoarme konzentrische Wandverdickung (Halo) der betroffenen Abschnitte. Dieses sog. Halo-Zeichen hat die höchste Sensitivität für die Diagnose einer kranialen RZA. Weitere duplexsonographische Merkmale sind Stenosen und Verschlüsse der Temporalarterien sowie eine fehlende Komprimierbarkeit.[8][9] Gemäß Empfehlungen der Europäischen Rheumaliga (European League against Rheumatism – EULAR) ist die Duplex-Sonographie der Temporalarterien ggf. inklusive der Aa. axillares die Methode erster Wahl in der Diagnostik einer RZA mit kranialem Befallsmuster.[10]
Magnetresonanztomographie
Mittels Magnetresonanztomographie (MRT) der Schädelarterien kann die Diagnose einer kranialen RZA mit einer noch höheren Sensitivität von 93 % als mittels Sonographie mit 78 % gestellt werden, während die Spezifität bei der Sonographie mit 91 % höher ist als bei der MRT mit 81 %. Daher empfiehlt die Europäische Rheumaliga den Einsatz der MRT als Alternative zur Sonographie.[10]
Temporalarterienbiopsie
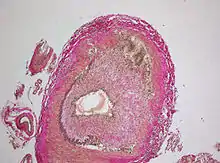
Immer noch häufig wird die Diagnose einer kranialen RZA durch einen kleinen operativen Eingriff mit Biopsie der Temporalarterie gesichert. Die Biopsie der Arteria temporalis galt lange als der Goldstandard zum Nachweis einer RZA. Gemäß den neueren EULAR-Empfehlungen ist die nicht-invasive Bildgebung der Biopsie zunächst vorzuziehen. Bei eindeutigem klinischen Bild und positivem Befund in der Bildgebung, ist keine Biopsie mehr zur Diagnosestellung erforderlich. Ist die Bildgebung nicht eindeutig, kann die Biospie bei der weiteren Abklärung helfen.[10] Der Eingriff kann in Lokalanästhesie – auch ambulant – durchgeführt werden. Die Biopsie erfolgt meist einseitig. Es sollte ein ca. 2,5 cm langes Arterienstück entfernt werden.[11] Da auch nur einzelne Segmente der Gefäße befallen sein können, schließt ein negativer Befund die Erkrankung nicht sicher aus. Histologisch zeigt sich eine Panarteriitis mit granulomatöser Entzündung der Tunica media, mit überwiegend mononuklärem Infiltrat der Tunica adventitia. Die namensgebenden Riesenzellen befinden sich meist zwischen Intima und Media. Zusätzlich können Kalzifikationen in der Intima beobachtet werden.
Augenärztliche Untersuchung
Das typische Symptom ist eine einseitige, plötzliche Verschlechterung der Sehschärfe oder des Gesichtsfeldes. Ursache hierfür ist typischerweise ein Verschluss der die Netzhaut oder den Sehnerven versorgenden Gefäße: In der Ophthalmoskopie ist die Papille des Sehnervs blass und ödematös (entzündliche anteriore ischämische Optikusneuropathie). Dadurch wird ihr Rand unscharf begrenzt. Es kann jedoch auch zu kompletten oder inkompletten Verschlüssen der Arterien oder Venen der Netzhaut kommen. Die Netzhautarterien sind dann fadendünn und zeigen unregelmäßige Reflexe wegen der Wandverdickung im Rahmen der Entzündung.
Labor
Bei den Laboruntersuchungen sind Entzündungszeichen wie eine stark erhöhte Blutsenkungsgeschwindigkeit (BSG), wobei von einer Sturzsenkung gesprochen werden kann, erhöhtes C-reaktives Protein (CRP), Leukozytose mit Eosinophilie, Alpha-2-Globulin-Vermehrung sowie eventuell eine Eisenmangelanämie feststellbar.
Differentialdiagnose
Therapie
Die RZA ist ein Notfall. Bereits bei dringendem Verdacht auf die Erkrankung werden systemisch hochdosiert Glukokortikoide (Cortisonpräparate) verabreicht, nicht zuletzt da die Entzündung auf die Hirngefäße übergreifen und dann zu einem lebensbedrohlichen Schlaganfall führen kann. Die Aussagekraft einer Biopsie wird in den ersten Tagen durch die Cortisongabe nicht beeinträchtigt. In den Leitlinien der Deutschen Gesellschaft für Neurologie wird 2003 bei fehlender Augenbeteiligung eine Dosis von 60–100 mg, bei frischer einseitiger Erblindung von 200–500 mg und bei drohender Erblindung von 500–1000 mg pro Tag empfohlen. Anschließend ist eine Erhaltungstherapie mit herabgesetzter Dosis über Jahre notwendig, etwa die Hälfte der Patienten kann nach zwei Jahren die Therapie beenden.
Methotrexat
Um die Nebenwirkungen des Cortisons zu verringern oder zu vermeiden, kann das bei entzündlich-rheumatischen Erkrankungen wirksame Zytostatikum Methotrexat (MTX) als Basistherapie (DMARD) eingesetzt werden. Dabei ist die eingesetzte Menge an Methotrexat sehr viel niedriger als in der Krebstherapie.[12][13]
Tocilizumab
Bisher gab es keine spezifische Therapie, und die langandauernde Glukokortikoidbehandlung konnte zu erheblichen Komplikationen führen. Im Mai 2017 konnte Tocilizumab als erstes spezifisches Medikament zur Behandlung der Riesenzellarteriitis als Break-through-Therapie in einem fast-track-Verfahren mit verkürztem Review von der amerikanischen Zulassungsbehörde FDA zugelassen werden, zwei Monate vor offizieller Publikation der Phase-III-Studie.[14] Der humanisierte monoklonale Antikörper gegen den Interleukin-6 (IL-6)-Rezeptor hemmt damit einen der zentralen Entzündungsmediatoren. In der randomisierten Placebo-kontrollierten Doppelblind-Studie wurden 251 mindestens 50 Jahre alte Patienten (75 % Frauen, 97 % Weiße) behandelt, von denen 100 wöchentlich, 50 zweiwöchentlich Tocilizumab subkutan erhielten, während das Prednisolon über 26 Wochen reduziert wurde. In der ersten Placebo-Gruppe mit 50 Patienten wurde Prednisolon auch über 26 Wochen reduziert, in der zweiten Placebo-Gruppe (51 Patienten) über 52 Wochen. Nach 52 Wochen waren 56 % bzw. 53 % in den Tocilizumab-Gruppen bzw. 14 % und 18 % in den Placebogruppen in anhaltender Remission. Die kumulative Predisolon-Menge betrug im Mittel 1862 mg in den beiden Therapiegruppen und 3296 mg bzw. 3818 mg in den Placebogruppen.
Erhebliche Nebenwirkungen wurden in 15 % und 14 % der Therapiegruppen und 22 % bzw. 25 % in den Placebogruppen beobachtet. Zu einer Optikus-Neuropathie kam es einmal in der zweiten Therapiegruppe.[15] Trotzdem bedarf es weiterer Studien und Verlaufsbeobachtungen, da möglicherweise Tocilizumab nur die Manifestation der Riesenzellarteriitis in Form der IL-6-getriggerten systemischen Entzündung blockiert, nicht aber die eigentliche Arteriitis. Auch könnte IL-6 neben der proinflammatorischen Wirkung die Angiogenese fördern und das Erblindungs-Risiko reduzieren. Auch das Risiko opportunistischer Infektionen ist nicht geklärt.[16]
Prognose
Die RZA spricht auf die Glucocorticoid-Therapie anfangs meist gut an. Bereits eingetretene Erblindungen sind allerdings häufig auch bei angemessener Therapie irreversibel.
In Langzeitstudien wurden bei der Mehrzahl der Betroffenen ein oder mehrere Rezidive der Erkrankung beobachtet.[17][18] Bei Patienten mit Rezidiven tritt infolge höherer Glucocorticoid-Dosen gehäuft Osteoporose auf.[18]
Literatur
- Matthias Sachsenweger: Augenheilkunde (= Duale Reihe). 2., vollständig überarbeitete und erweiterte Auflage. Georg Thieme, Stuttgart u. a. 2003, ISBN 3-13-128312-2, S. 316–317.
- Ultraschalldiagnostik bei Arteriitis cranialis: Möglichkeiten und Grenzen. In: Dt. Ärzteblatt, 9. Dezember 2005
Einzelnachweise
- Gerd Herold: Innere Medizin. Köln 2007, S. 611.
- Klaus Poeck, Werner Hacke: Neurologie. 12., aktualisierte und erweiterte Auflage. Springer, Heidelberg 2006, ISBN 3-540-29997-1, S. 412–413.
- Don Gilden et al.: Prevalence and distribution of VZV in temporal arteries of patients with giant cell arteritis. In: Neurology. 12. Mai 2015, abgerufen am 20. April 2016 (englisch).
- Thorsten Klink, Julia Geiger, Marcus Both, Thomas Ness, Sonja Heinzelmann: Giant Cell Arteritis: Diagnostic Accuracy of MR Imaging of Superficial Cranial Arteries in Initial Diagnosis—Results from a Multicenter Trial. In: Radiology. Band 273, Nr. 3, 6. August 2014, ISSN 0033-8419, S. 844–852, doi:10.1148/radiol.14140056 (rsna.org [abgerufen am 31. Mai 2019]).
- Simon Veldhoen, Thorsten Klink, Julia Geiger, Peter Vaith, Cornelia Glaser: MRI displays involvement of the temporalis muscle and the deep temporal artery in patients with giant cell arteritis. In: European Radiology. Band 24, Nr. 11, 1. November 2014, ISSN 1432-1084, S. 2971–2979, doi:10.1007/s00330-014-3255-1.
- Hubert de Boysson, Eric Liozon, Olivier Espitia, Aurélie Daumas, Mathieu Vautier: Different patterns and specific outcomes of large-vessel involvements in giant cell arteritis. In: Journal of Autoimmunity. 24. Mai 2019, ISSN 0896-8411, doi:10.1016/j.jaut.2019.05.011 (sciencedirect.com [abgerufen am 31. Mai 2019]).
- Hubert de Boysson, Aurélie Daumas, Mathieu Vautier, Jean-Jacques Parienti, Eric Liozon: Large-vessel involvement and aortic dilation in giant-cell arteritis. A multicenter study of 549 patients. In: Autoimmunity Reviews. Band 17, Nr. 4, April 2018, S. 391–398, doi:10.1016/j.autrev.2017.11.029 (elsevier.com [abgerufen am 26. Mai 2019]).
- Wolfgang Andreas Schmidt: Duplex-Sonographie in der Diagnostik der Arteriitis temporalis und anderer Vaskulitiden. Habilitationsschrift. Humboldt-Universität, Medizinische Fakultät Charité, Berlin 2002.
- Thomas Daikeler, Christof Rottenburger, Daniel Staub, Markus Aschwanden, Gregor Sommer: The clinical benefit of imaging in the diagnosis and treatment of giant cell arteritis. In: Swiss Medical Weekly. Band 148, Nr. 3334, 22. August 2018, doi:10.4414/smw.2018.14661 (smw.ch [abgerufen am 31. Mai 2019]).
- Christian Dejaco, Sofia Ramiro, Christina Duftner, Florent L Besson, Thorsten A Bley, Daniel Blockmans, Elisabeth Brouwer, Marco A Cimmino, Eric Clark, Bhaskar Dasgupta, Andreas P Diamantopoulos, Haner Direskeneli, Annamaria Iagnocco, Thorsten Klink, Lorna Neill, Cristina Ponte, Carlo Salvarani, Riemer H J A Slart, Madeline Whitlock, Wolfgang A Schmidt: EULAR recommendations for the use of imaging in large vessel vasculitis in clinical practice. Hrsg.: Annals of Rheumatic Diseases. Band 77, 2018, S. 636–643, doi:10.1136/annrheumdis-2017-212649.
- T. Ness, T. Bley, W. Schmidt, P. Lamprecht: Diagnose und Therapie der Riesenzellarteriitis. In: Deutsches Ärzteblatt. 2013, 21, S. 381.
- M. Brody, I. Böhm, R. Bauer: Mechanism of action of methotrexate: experimental evidence that methotrexate blocks the binding of interleukin 1 beta to the interleukin 1 receptor on target cells. In: European journal of clinical chemistry and clinical biochemistry : journal of the Forum of European Clinical Chemistry Societies. Band 31, Nummer 10, Oktober 1993, S. 667–674, PMID 8292668.
- I. B. Boehm, G. A. Boehm, R. Bauer: Management of cutaneous lupus erythematosus with low-dose methotrexate: indication for modulation of inflammatory mechanisms. In: Rheumatology international. Band 18, Nummer 2, 1998, S. 59–62, PMID 9782534.
- FDA: FDA News Release - FDA approves first drug to specifically treat giant cell arteritis, 22. Mai 2017,
- John H. Stone, Katie Tuckwell, Sophie Dimonaco, Micki Klearman, Martin Aringer, Daniel Blockmans, Elisabeth Brouwer, Maria C. Cid, Bhaskar Dasgupta, Juergen Rech, Carlo Salvarani, Georg Schett, Hendrik Schulze-Koops, Robert Spiera, Sebastian H. Unizony, Neil Collinson: Trial of Tocilizumab in Giant-Cell Arteritis. New England Journal of Medicine 2017, Band 377, Ausgabe 4 vom 27. Juli 2017, Seiten 317–328, [DOI: 10.1056/NEJMoa1613849]
- David B. Hellmann: Giant-Cell Arteritis — More Ecstasy, Less Agony New England Journal of Medicine 2017, Band 377, Ausgabe 4 vom 27. Juli 2017, Seiten 385–386, [DOI: 10.1056/NEJMe1706439]
- Cristian Labarca, Matthew J. Koster u. a.: Predictors of relapse and treatment outcomes in biopsy-proven giant cell arteritis: a retrospective cohort study. In: Rheumatology. 55, 2016, S. 347–356, DOI:10.1093/rheumatology/kev348.
- Marco A. Alba, Ana García-Martínez u. a.: Relapses in Patients With Giant Cell Arteritis. In: Medicine. 93, 2014, S. 194–201, DOI:10.1097/MD.0000000000000033.