Prostacyclinsynthase
Prostacyclinsynthase (Gen: PTGIS) ist das Enzym, das die Umlagerung von Prostaglandin H2 nach Prostacyclin katalysiert. Diese Reaktion ist das Gegengewicht zur Umwandlung nach Thromboxan A2, und auch die Reaktionsprodukte sind physiologische Gegenspieler. Die Synthase kommt in Wirbeltieren vor. Beim Menschen ist sie als Membranprotein in allen Gewebetypen, besonders aber in Ovarien, Herz, Skelettmuskeln, Lunge und Prostata zu finden.[1]
| Prostacyclinsynthase | ||
|---|---|---|
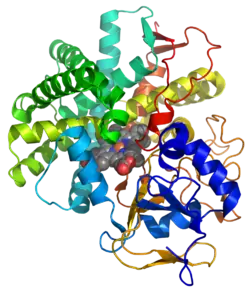 | ||
| Bändermodell mit Häm im Zentrum (Kalotten) nach PDB 2IAG | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 57,1 Kilodalton / 500 Aminosäuren | |
| Sekundär- bis Quartärstruktur | single pass Membranprotein | |
| Kofaktor | Häm-Thiolat | |
| Bezeichner | ||
| Gen-Namen | PTGIS ; CYP8A1 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 5.3.99.4, Isomerase | |
| Reaktionsart | Umlagerung | |
| Substrat | Prostaglandin H2 | |
| Produkte | Prostacyclin | |
| Vorkommen | ||
| Übergeordnetes Taxon | Wirbeltiere | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 5740 | 19223 |
| Ensembl | ENSG00000124212 | ENSMUSG00000017969 |
| UniProt | Q16647 | O35074 |
| Refseq (mRNA) | NM_000961 | NM_008968 |
| Refseq (Protein) | NP_000952 | NP_032994 |
| Genlocus | Chr 20: 49.5 – 49.57 Mb | Chr 2: 167.19 – 167.24 Mb |
| PubMed-Suche | 5740 | 19223 |
Prostacyclinsynthase ist in der Membran des endoplasmatischen Reticulums auf der Innenseite lokalisiert und ist über ein Fusionsprotein eng assoziiert mit den Enzymen COX-1/COX-2. Als Gegenspieler einer Thromboxan A2-erzeugten Thrombose ist die Prostacyclinsynthase ein gentherapeutisches Target für die Behandlung der pulmonalen Hypertonie.[2][3][4]
Katalysierte Reaktion
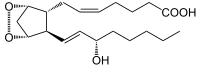 ⇒
⇒ 
Prostaglandin H2 wird zu Prostaglandin I2 (Prostacyclin) umgelagert.
Weitere Funktionen
Bestimmte Varianten der Prostacyclinsynthase waren assoziiert mit schwerem Verlauf einer Respiratory-Syncytial-Virus-Infektion japanischer Kinder.[5]
Regulation
Signaltransduktion von Tretinoin über den Retinsäure-Rezeptor erhöht die Expression von Prostacyclinsynthase. Enzymaktivität wird gehemmt durch Peroxynitrit, was durch Glutathion oder Vitamin C verhindert wird.[6][7]
Weblinks
- Jassal/D'Eustachio/reactome.org: Prostacyclin synthase (CYP8A1) mediates the isomerization of prostaglandin H2 to prostaglandin I2
Einzelnachweise
- UniProt Q16647
- Wu KK, Liou JY: Cellular and molecular biology of prostacyclin synthase. In: Biochem. Biophys. Res. Commun.. 338, Nr. 1, Dezember 2005, S. 45–52. doi:10.1016/j.bbrc.2005.08.021. PMID 16115610.
- Ruan KH, Deng H, So SP: Engineering of a protein with cyclooxygenase and prostacyclin synthase activities that converts arachidonic acid to prostacyclin. In: Biochemistry. 45, Nr. 47, November 2006, S. 14003–11. doi:10.1021/bi0614277. PMID 17115695.
- Ito T, Okada T, Mimuro J, et al: Adenoassociated virus-mediated prostacyclin synthase expression prevents pulmonary arterial hypertension in rats. In: Hypertension. 50, Nr. 3, September 2007, S. 531–6. doi:10.1161/HYPERTENSIONAHA.107.091348. PMID 17635855.
- Hashimoto K, Ishibashi K, Gebretsadik T, et al: Functional polymorphism of the promoter region of the prostacyclin synthase gene and severity of RSV infection in hospitalized children. In: J. Med. Virol.. 80, Nr. 11, November 2008, S. 2015–22. doi:10.1002/jmv.21318. PMID 18814254.
- Camacho M, Rodríguez C, Salazar J, et al: Retinoic acid induces PGI synthase expression in human endothelial cells. In: J. Lipid Res.. 49, Nr. 8, August 2008, S. 1707–14. doi:10.1194/jlr.M700559-JLR200. PMID 18458045.
- Zou MH: Peroxynitrite and protein tyrosine nitration of prostacyclin synthase. In: Prostaglandins Other Lipid Mediat.. 82, Nr. 1–4, Januar 2007, S. 119–27. doi:10.1016/j.prostaglandins.2006.05.005. PMID 17164139.