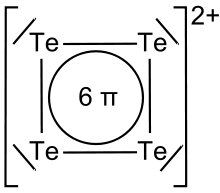
Polykation
Polykationen sind Teilchen aus mehreren Atomen desselben Elements, die sich zusammengelagert haben und als Verband eine positive Ladung besitzen. Die Zahl der bekannten polykationischen Verbindungen von Hauptgruppenelementen ist weit geringer als die der polyanionischen Verbindungen. Beispiele sind die Kationen der Chalkogene wie S42+, S82+, Se102+ oder Te62+, die dann entstehen, wenn die Elemente unter oxidierenden Bedingungen mit Lewis-Säuren reagieren. Die Begriffe Polyanion und Polykation wurden um 1930 von Eduard Zintl geprägt.
Darstellung
Oxidationsmittel wie z. B. Peroxodisulfuryldifluorid S2O6F2 in Fluorschwefelsäure HSO3F oder Schwefeltrioxid SO3 in Schwefelsäure führen Selen (Se) oder Tellur (Te) in Kationen über. Darüber hinaus entstehen die Kationen durch Komproportionierung oder Disproportionierung von Se, Te in AlCl3-haltigen SO2-Lösungen. Die Tendenz des Selens und Tellurs zur Kationenbildung ist insgesamt größer als die des elektronegativeren Schwefels, die Acidität der Se- und Te-Kationen kleiner als die der Schwefelkationen.
Das rote Te42+-Kation (Tetratellur-Dikation) kann beispielsweise aus elementarem Tellur durch Oxidation in heißer konzentrierter Schwefelsäure (H2SO4) dargestellt werden. Ein Teil der Schwefelsäure wird bei der Reaktion zu Schwefliger Säure (H2SO3) reduziert, die aufgrund der hohen Temperaturen in Wasser (H2O) und ihr Anhydrid Schwefeldioxid (SO2) zerfällt, welches als Gas entweicht:
Diese Reaktion dient als qualitativer Nachweis von Tellur in einem Analysengemisch.
Strukturen
Strukturen verschiedener Polykationen der Chalkogene:
 Se102+
Se102+ Te62+
Te62+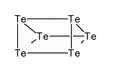 Te64+
Te64+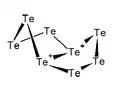 Te82+
Te82+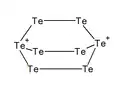 Te82+
Te82+ Te84+
Te84+x.png.webp) (Te42+)x
(Te42+)xx.png.webp) (Te72+)x
(Te72+)xx.png.webp) (Te102+)x
(Te102+)x
Quellen
- Ulrich Müller: Anorganische Strukturchemie. Vieweg+Teubner, Wiesbaden 2008, ISBN 978-3-8348-0626-0, S. 204 f.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 622.
- Uni Gießen: Untersuchungen zur Reaktivität von Chalkogenpolykationen-Hexachlorozirkonaten und -hafnaten (PDF; 3,7 MB)
- Uni-Bonn: Cluster
- Uni-Bonn: Galerie