Platin(II)-oxid
Platin(II)-oxid (auch Platinmonoxid) ist eines von mehreren Oxiden des chemischen Elementes Platin. Daneben existieren noch Platin(IV)-oxid und Platin(VI)-oxid.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| _ Pt2+ _ O2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Platin(II)-oxid | |||||||||||||||
| Andere Namen |
Platinmonoxid | |||||||||||||||
| Verhältnisformel | PtO | |||||||||||||||
| Kurzbeschreibung |
schwarzer bis violetter Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 211,08 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
14,9 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Platin(II)-oxid lässt sich durch Erhitzen von Platin auf 430 °C in einer Sauerstoff-Atmosphäre mit erhöhten O2-Druck gewinnen. Platin(IV)-oxid zerfällt ab 400 °C zu Platin(II)-oxid und Sauerstoff.
Es kann auch durch vorsichtiges Erhitzen von Platin(II)-hydroxid unter Abspaltung von Wasser gewonnen werden:[2]
Eigenschaften
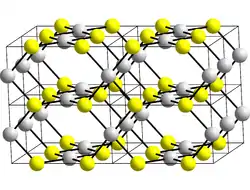
Platin(II)-oxid kristallisiert wie Palladium(II)-oxid nicht in einer Natriumchlorid-, sondern in einer Platinsulfid-Struktur. In dieser liegen kantenverknüpfte Quadrate einer PtO4-Struktur vor. Daneben sind die Platin- und Sauerstoffatome in Bändern angeordnet.
Mit Ausnahme von Königswasser ist Platin(II)-oxid in Säuren unlöslich. Als starkes Oxidationsmittel wird es auch von schwachen Reduktionsmitteln wie Wasserstoff bei Raumtemperatur zum Element reduziert.
Das durch Reaktion von Platin(II)-lösungen mit Natronlauge gebildete Platinmonoxid-hydrat lässt sich nicht ohne Sauerstoffabgabe zu Platin(II)-oxid dehydratisieren. Versucht man es unter Anwesenheit von Sauerstoff zu entwässern, bildet sich stattdessen ein Platin(III)-oxid-hydrat.
Einzelnachweise
- Datenblatt bei Webelements
- Simon Cotton: Chemistry of Precious Metals, 1997, S. 725.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1732.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Platinum oxide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 29. Juli 2019.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1732–1734.